INFECCIÓN POR VIRUS DE HEPATITIS C
FISIOPATOLOGÍA
El virus de la hepatitis C (VHC) es un virus de ácido ribonucleico (ARN) de cadena positiva en la familia Flaviviridae, que también incluye flavivirus clásicos como el de la fiebre amarilla y el dengue. Después de la inoculación por cualquier vector o medio que ponga en contacto sangre con carga de VHC en un nuevo huésped, se lleva a cabo todo el proceso de replicación viral y los procesos inmunes y patológicos que implica.
Genoma viral
Aunque se desconoce el origen del VHC y el momento en que se introdujo como patógeno en la población humana, la alta tasa de error en la replicación dependiente de ARN y la interacción entre virus y huésped, ha generado una notable diversidad global. Actualmente, las cepas de VHC se clasifican en siete genotipos reconocidos (1-7); éstas mismas difieren en 30-35% de los sitios de los nucleótidos. Dentro de cada genotipo, el VHC se clasifica en 67 subtipos confirmados y 20 subtipos provisionales. Las cepas que pertenecen al mismo subtipo difieren en <15% de los sitios de nucleótidos. La distribución geográfica global contemporánea de los genotipos de VHC es compleja; ya se ha establecido que algunos subtipos, específicamente 1a, 1b, 2a y 3a, están ampliamente distribuidos en todo el mundo y representan una gran proporción de las infecciones por el VHC en los países de altos ingresos.
El genoma del VHC contiene regiones 5' y 3' no traducidas con un marco de lectura abierto amplio que se traduce a través de un sitio interno de entrada al ribosoma. La poliproteína resultante se procesa para producir proteínas estructurales (núcleo, E1 y E2) y no estructurales (p7, NS2, NS3, NS4A, NS4B, NS5A y NS5B). La replicación viral asociada a la membrana tiene lugar en el citoplasma, el ensamblaje y liberación a través de las vías secretoras, están asociadas con la biogénesis de lipoproteínas.
Inoculación y replicación
Para llegar a comprender el fenómeno de inoculación y replicación, fue necesario observar y analizar pacientes con infección crónica, los cuales, en las muestras sanguíneas, presentan cargas virales que varían entre 103-107 genomas por mL de suero. Se realizó un modelo matemático sobre la dinámica viral durante un tratamiento con interferón-alfa (IFN-α) en el cual se observó que los viriones de VHC cambian rápidamente (con una vida media de 3h) produciéndose aproximadamente hasta 1012 virus por día en una persona infectada; esto es 100 veces mayor que la tasa reportada para el VIH.
Se observan altas cargas virales durante las primeras semanas de la infección por el VHC, pero los procesos inflamatorios que conducen a la lesión hepática se retrasan, por lo general después de 2-3 meses.
Después de la unión inicial del VHC a la célula huésped (hepatocito), el virus se une a receptores de alta afinidad para el VHC, el primer factor de entrada identificado y mejor caracterizado es el tetraspanin CD81, inicialmente demostrando que interactuaba con la glicoproteína E2 del VHC. Como todos los miembros de la familia de tetraspanina, CD81 está compuesto de cuatro secuencias transmembrana, un pequeño bucle extracelular y un bucle extracelular largo. El dominio bucle largo extracelular es la región crítica para la interacción con la glicoproteína de la envoltura E2 y para la entrada del virus.
Ciclo viral del VHC
Las partículas circulantes virales envueltas interactúan con receptores de superficie específicos, la fusión de membranas virales y celulares, desencadenada probablemente por el pH bajo del compartimento endocítico, conduce a la liberación de un genoma de ARN monocatenario en sentido positivo en el citoplasma de la célula recién infectada. Los viriones presumiblemente se forman en el retículo endoplasmático (RE) y dejan a la célula mediante la vía secretora.
Traducción
El genoma del VHC cumple múltiples funciones dentro del ciclo de vida, primero, como un ARN mensajero (ARNm) para la traducción de las proteínas virales. La interacción de lipoviropartículas ([LVP] Imagen parte [1]) de VHC extracelulares con receptores de superficie celular inicia el proceso de entrada (Imagen parte [2]), que también puede ocurrir a partir de la transmisión directa de célula a célula. Después de la fusión dependiente de pH sin recubrimiento, se traduce el genoma de VHC entrante y se procesa la poliproteína resultante (inserción inferior imagen parte [3]).
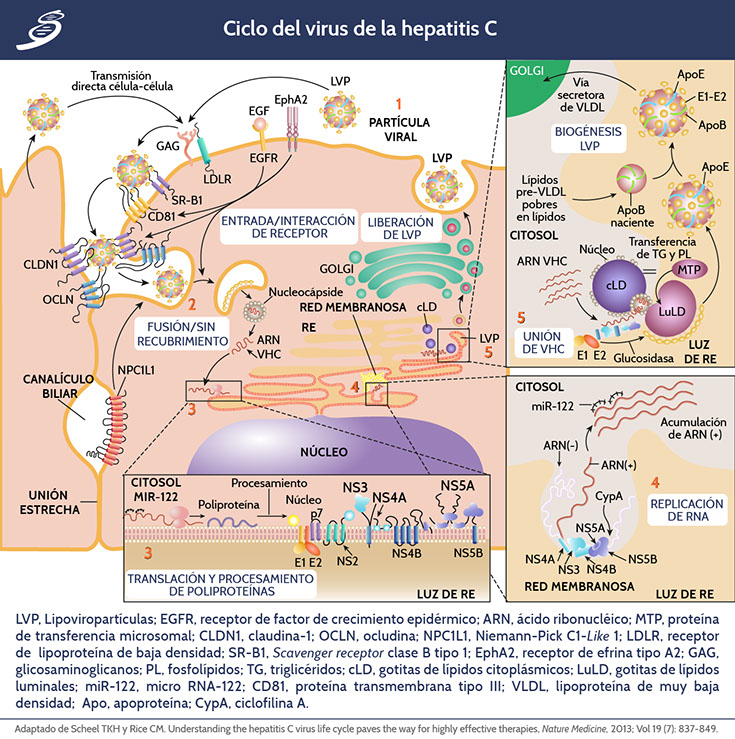
Replicación
La replicación tiene lugar en esférulas de membrana derivadas de RE (imagen previa parte [4]), cuya arquitectura no está definida del todo. La contribución espacio-temporal de la unión de miR-122 al genoma del VHC aún no se comprende por completo.
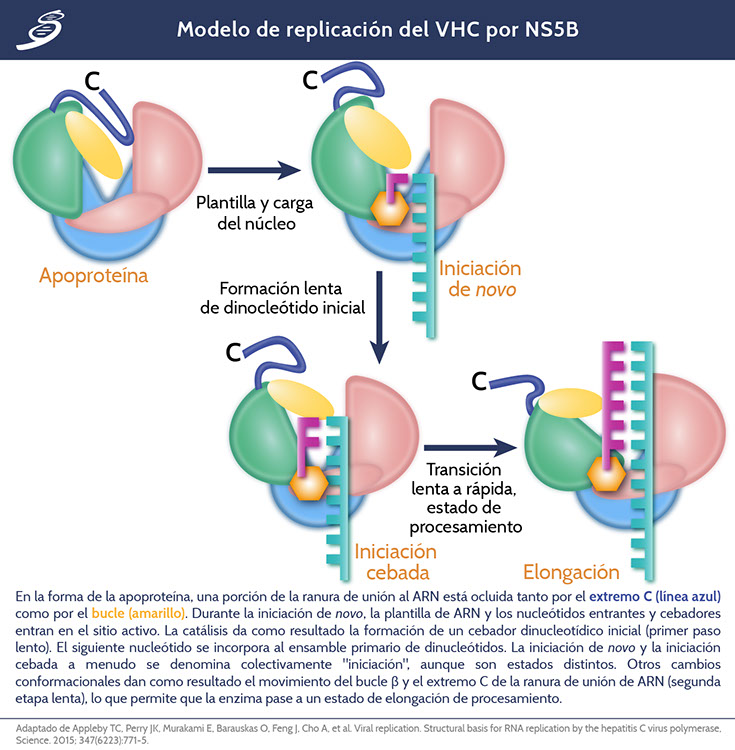
Se ha propuesto un modelo de los eventos estructurales implicados en la replicación del genoma del VHC (se muestra en la siguiente imagen). Al principio, el bucle β y el enlazador de anclaje a membrana C-terminal están enterrados dentro de la cavidad circulada del sitio activo. En el primero de dos pasos lentos en la replicación del ARN del VHC, el extremo 3' del molde de ARN viral y los nucleótidos entran en el sitio activo, posiblemente con cambios conformacionales acompañantes; aquí, en la etapa inicial de transferencia de fosforilo, se genera un cebador dinucleótido. Este paso de iniciación de novo precede inmediatamente al ensamblado del cebador (primer) capturado aquí. En esta etapa temprana el complejo permanece inestable, lo que puede explicar la gran cantidad observada de transcripciones abortivas de dos a cuatro nucleótidos. A medida que el cebador de dinucleótidos se extiende por otro u otros tres nucleótidos, la acumulación de tensión desplaza el bucle β y los residuos restantes C-terminales, causando mayor apertura de la cavidad y permitiendo que el dúplex de ARN salga durante el segundo paso lento en la replicación. Con ambos, el bucle β y el extremo C son expulsados de la cavidad del sitio activo, las transiciones de la polimerasa en el modo de elongación altamente progresiva, también se capturan aquí.
Empaquetamiento de nuevos viriones
En el proceso de ensamblaje y liberación (primer imagen parte [5]), la proteína del núcleo se transfiere de las gotitas de lípidos citoplásmicas (cLDs) para formar nucleocápsides que, asistidas por NS5A, se cargan con ARN. Se cree que las proteínas de replicación se unen al ARN del VHC durante la transferencia de la replicación al empaquetamiento, cuyos sitios intracelulares podrían converger. No está claro si el ARN está ubicado transitoriamente en las cLDs. Las proteínas p7, NS2 y NS3-NS4A también participan en la coordinación del ensamblaje. La morfogénesis del virión del VHC está acoplada a la ruta de las lipoproteínas de muy baja densidad (VLDL), y a las partículas que se producen como lipoviropartículas, las cuales también se asocian con apolipoproteína C (ApoC).
Liberación del virus
La liberación final del virus es un proceso regulado y acoplado a la síntesis lipídica de la célula huésped, esto probablemente para mejorar el hepatotropismo y contribuir a la persistencia de la infección. En los microdominios ricos en lípidos del RE, se piensa que la nucleocápside se transfiere a las gotas de lípidos luminales (luLD), que son precursoras de partículas de VLDL. Las gotas de lípidos luminales que contienen nucleocápsides se fusionan con partículas pre-VLDL que contienen apoB para formar lipoviropartículas, que también adquieren apoE y apoC, que salen a través del aparato de Golgi. La proteína de transferencia microsomal del RE intraluminal es responsable de la transferencia de triglicéridos y fosfolípidos a las gotas de lípidos luminales nacientes y se han implicado en el ensamblaje de VHC.
Los viriones de VHC envueltos tienen un diámetro de 50-80 nm, con heterodímeros de glucoproteína E1 y E2 incrustados en la bicapa lipídica que rodea una nucleocápside compuesta de proteína central y genoma de ARN monocatenario, son transmitidos a otros hepatocitos en la circulación o por contigüidad para su replicación.
Bibliografía
Messina JP, Humphreys I, Flaxman A, Brown A, Cooke GS, Pybus OG, et al. Global Distribution and Prevalence of Hepatitis C Virus Genotypes, HEPATOLOGY, 2015;61:77-87.
Scheel TKH y Rice CM. Understanding the hepatitis C virus life cycle paves the way for highly effective therapies, Nature Medicine, 2013; Vol 19 (7): 837-849.
Lindenbach BD y Rice CM. Unravelling hepatitis C virus replication from genome to function, NATURE, 2005; Vol. 436: 933-938.
Appleby TC, Perry JK, Murakami E, Barauskas O, Feng J, Cho A, et al. Viral replication. Structural basis for RNA replication by the hepatitis C virus polymerase, Science. 2015; 347(6223):771-5.
Dubuisson J, Helle F, Cocquerel L. Early steps of the hepatitis C virus life cycle, Cell Microbiol. 2008; 10(4):821-7.
Periodismo científico cultural
Sobre el cigarro electrónico
Ya ha pasado tiempo desde que el cigarro se convirtió en el enemigo público número uno, tanto para fumadores como para no fumadores...
[leer mas]
la sal! Tu cerebro
y corazón lo agradecerán
La enfermedad diverticular y sus complicaciones son una causa importante de morbimortalidad en todo el mundo...
[leer mas]
El primer anticuerpo monoclonal para pacientes con hemofilia A e inhibidores a FVIII
Cuando se vive con hemofilia todo puede ser una amenaza para provocar sangrados; desde niños...
[leer mas]
Infografías
TODOS LOS DERECHOS RESERVADOS © SPG COMUNICACIONES SA DE CV 2012-2018
Diseño: A. Victoria Pérez
Aviso de privacidad




