ENFERMEDADES EXANTEMÁTICAS DE LA INFANCIA
FISIOPATOLOGÍA
Roséola
La roseola infantum es una enfermedad causada por un virus de la familia herpes viridae, virus del herpes humano-6 (HHV-6 por sus siglas en inglés), el cual tiene dos variantes A y B; también se le conoce como exantema súbito o sexta enfermedad de la infancia. Fue documentada por primera vez como entidad clínica única por el médico John Zahorsky en 1910, quien describió un eritema pigmentado rosa que aparecía después de un periodo prodrómico de fiebre alta en niños menores de 3 años. Además de HHV-6 como etiología más frecuente, otras causas incluyen HHV-7, enterovirus como coxsackie A y B, echoviruses, adenovirus y virus de la parainfluenza tipo 1.
Infección por HHV-6
La infección por HHV-6 tiene un pico de aparición en los lactantes entre los 6-18 meses de edad, pero puede presentarse aun después en niños no mayores de 3 años. La patogenia de la roséola como tal no se conoce, se ha estudiado reconociendo el siguiente patrón: durante los primeros 2 días de la enfermedad (antes de la aparición de la erupción) es posible detectar la viremia en leucocitos, glándulas salivares y saliva en niños hasta los días 5-7 (aproximadamente). Es posible detectar anticuerpos anti HHV-6 desde el día 3 y en el día 8 en un niño inmunocompetente ya debe estar presente en la sangre. Este patrón de viremia que precede la erupción y la erupción coincidente con el desarrollo de anticuerpos, sugiere que la erupción puede ser el resultado de complejos antígeno-anticuerpo.
Sobre su modo de transmisión, se ha observado en estudios que la infección primaria por HHV-6B es adquirida durante los primeros 24 meses de vida, de manera probable a través de contacto con saliva de adultos portadores o hermanos mayores. Además, en estudios realizados en madres e hijos con perfiles de enzimas de restricción en ácido desoxirribonucleico (ADN), se ha demostrado que los aislados de las madres son genéticamente similares a los de sus bebés. Se ha documentado una transmisión vertical de HHV, sin embargo, este modo de transmisión representa únicamente el 1-2% de los nacimientos.
Herpes virus tipo 6 (HHV-6)
El HHV-6 pertenece a la subfamilia de Betaherpesvirinae y al género Roseolovirus; las partículas de los viriones tienen una estructura típica de virus de herpes con un núcleo central que contiene ADN viral, una cápside y una capa de tegumento rodeada por una membrana. Actualmente, una de sus principales características es que se reconoce como un virus linfotrófico de célula T con alta afinidad para los linfocitos T CD4+ donde se replica de manera efectiva, con un periodo medio de incubación de 9 a 10 días.
El HHV-6 tiene la capacidad de permanecer latente en linfocitos y monocitos después de la infección primaria, así como también se alberga en glándulas salivales y tejido cerebral; los genomas de las dos variantes de HHV-6, A y B, han sido secuenciados siendo HHV-6B la causa principal de la roséola, consistente en 97 genes únicos. A nivel molecular, el HHV-6 codifica proteínas similares a las quimiocinas como mediadores inmunes; dichas quimiocinas funcionales son codificadas por un marco abierto de lectura U83, U12 y U51, codifican 7 proteínas transmembrana análogas a los receptores de quimiocinas. Este mimetismo molecular se ha entendido que ayuda al HHV-6 en la invasión inmune y a la latencia prolongada en las células del huésped.
Ambas variantes A y B del HHV-6 ingresan a la célula a través de la interacción con CD46, que está presente en la membrana de todas las células nucleadas y está fisiológicamente involucrada en la regulación del complemento. Esta glicoproteína también sirve como el receptor de las cepas vacunales del virus del sarampión. El complejo gH-gL-gQ (las glicoproteínas H, L y Q están codificadas por los genes H48-U48, U82 y U100, respectivamente) sirve como el ligando viral para CD46 humano (como se observa en la imagen). El gH es el factor responsable de la unión en los dominios cortos de repetición de consenso SCR2 y SCR3 de CD46. El HHV-6 gB (codificado por U39) también está involucrado en el proceso de fusión, a través de un mecanismo aún no definido. Después de unirse a su receptor y a la fusión mediada por gH-gL-gQ de la envoltura viral a la membrana celular, la nucleocápside entrante se transporta a través del citoplasma (muy probablemente por asociación con la red de microtúbulos) a complejos de poro nuclear, donde el ADN viral del genoma se libera en el nucleoplasma. Luego, el virus utiliza la maquinaria de transcripción y traducción celular para producir tres clases cinéticas de proteínas virales (IE, early [E] y late [L]). Las proteínas HHV-6 IE se sintetizan unas pocas horas después de la infección y regulan la expresión de otros genes. La replicación del ADN del virus requiere siete factores codificados por virus. Primero, la proteína de unión al origen (codificada por el gen HHV-6 U73), que está ausente en HCMV y en gamma-herpesvirinae, se une al origen de la replicación lítica (ori-lyt) y desnaturaliza una parte del genoma de ADN viral circular.
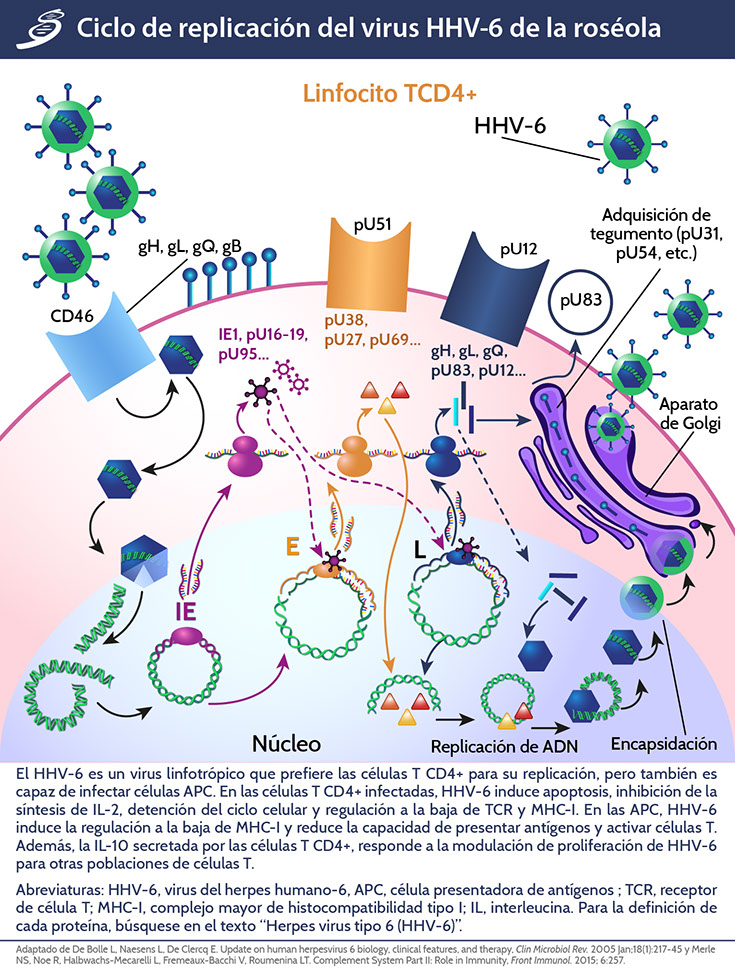
El ADN monocatenario en la "burbuja de replicación" se estabiliza mediante la principal proteína de unión al ADN (codificada por U41) hasta que la síntesis de la segunda cadena es catalizada por el ADN polimerasa (pU38), impulsada por un factor procesador (pU27) (obsérvese en la imagen anterior). Se sospecha que las cuatro proteínas codificadas por los genes U79 y U80 del HHV-6 también están implicadas en la replicación del ADN, aunque todavía no se conoce su función. A medida que la nueva cadena crece, la estructura de replicación circular se corta para formar un círculo enrollado intermedio. Las hebras concataméricas largas de ADN de su progenie están encapsuladas por la interacción de proteínas de división y empaquetamiento con señales de empaquetamiento (pac) específicas al final de los genomas virales. Es interesante que las secuencias de ori-lyt y pac sean diferentes para las variantes A y B de HHV-6. Las cápsides maduras brotan del núcleo (adquiriendo de ese modo temporalmente una membrana intermedia desprovista de glicoproteínas) en el citoplasma, donde adquieren un tegumento y una envoltura viral secundaria enriquecida en el complejo de Golgi o en lamelas anulares, donde se acumulan las glucoproteínas virales. Estos son glucosilados secuencialmente en vesículas de transporte antes de la liberación de la partícula de virus maduro en el espacio extracelular por exocitosis. La vía de maduración HHV-6 es diferente de la de los otros herpesvirus, ya que no se detectan glucoproteínas virales en la membrana celular de las células infectadas. El tiempo total desde la infección hasta la liberación de nuevos viriones (es decir, un ciclo de replicación) lleva aproximadamente 72 h.
Inmunidad
Como se mencionó, la variante primaria que causa roséola infantum es HHV-6B, el cual entra a las células T CD4+ por la vía de interacción con CD46 (receptor celular para HHV-6 que imparte el tropismo tisular amplio del virus). Es así como la vía de señalización intracelular a través de los receptores tipo Toll (TLR) es afectada por la infección por HHV-6, dado que este sistema de TLR es esencial para el reconocimiento de varios patógenos y la generación de inmunidad innata, la interrupción de la señalización mediada por los TLR parece ser la estrategia eficaz utilizada, por la cual los virus pueden evadir el sistema inmune. Además de este mecanismo, el HHV-6 regula negativamente la respuesta inmune del huésped a través del mimetismo molecular mediante la producción de quimiocinas funcionales.
Se cree también que el HHV-6B está involucrado en el proceso de fusión con la membrana celular (mecanismo no definido), la nucleocápside es transportada a través del citoplasma y el genoma viral de ADN es liberado en el nucleoplasma en los complejos de poros nucleares.
Complicaciones
Una de las complicaciones más comunes de la roséola son las convulsiones febriles. Por medio de estudios clínicos se ha demostrado que niveles altos de metaloproteinasa 9 e inhibidor tisular de las metaloproteinasas 1 en el suero de los niños (lactantes mayores, preescolares) infectados con HHV-6, puede conducir a disfunción en la barrera hematoencefálica (BHE) que puede resultar en convulsiones durante los picos febriles. Esta invasión temprana de la enfermedad al sistema nervioso central se ha descubierto por medio del análisis de líquido cefaloraquídeo (LCR) que han mostrado niveles altos de interleucina 1β (IL-1β) y factor de crecimiento fibroblástico, los cuales podrían contribuir al crecimiento de HHV-6 y el desarrollo de encefalitis, otra complicación grave. En una mínima proporción, se han reportado afectaciones generalizadas de órganos y sistemas con síndromes gastrointestinales y hematológicos, así como hepatitis y hepatoesplenomegalia durante la enfermedad primaria.
Bibliografía
Gorman CR. Roseola Infantum, Dermatology, [Updated: Aug 23, 2017] Disponible en:
https://emedicine.medscape.com/article/1133023-overview [revisado diciembre 2017]
Tremblay C, Brady MT. Roseola infantum (exanthem subitum), Up To Date, [review current through: Nov 2017-This topic last updated: Sep 01, 2017] disponible en: https://www.uptodate.com/contents/roseola-infantum-exanthem-subitum [revisado diciembre 2017]
Cherry JD. Roseola infantum (exanthem subitum). In: Feigin and Cherry’s Textbook of Pediatric Infectious Diseases, 7th ed, Cherry JD, Harrison GJ, Kaplan SL, et al (Eds), Elsevier Saunders, Philadelphia 2014. p.768.
Tanaka K, Kondo T, Torigoe S, et al. Human herpesvirus 7: another causal agent for roseola (exanthem subitum), J Pediatr 1994; 125:1.
Mullins TB, Krishnamurthy K. Roseola Infantum, NCBI Bookshelf, [Last Update: October 9, 2017] disponible en:
https://www.ncbi.nlm.nih.gov/books/NBK448190/?report=printable 1/ [revisado diciembre 2017]
Stone RC, Micali GA, Schwartz RA. Roseola infantum and its causal human herpesviruses, Int J Dermatol, 2014; 53(4):397-403.
Agut H. Deciphering the clinical impact of acute human herpesvirus 6 (HHV-6) infections, J Clin Virol, 2011; 52(3):164-71.
Murakami Y, Tanimoto K, Fujiwara H, An J, Suemori K, Ochi T, et al. Human herpesvirus 6 infection impairs Toll-like receptor signaling, Virol J, 2010; 7:91.
Pellett PE, Ablashi DV, Ambros PF, Agut H, Caserta MT, Descamps V, et al. Chromosomally integrated human herpesvirus 6: questions and answers, Rev Med Virol. 2012; 22(3):144-55.
Tamai M, Kobayashi N, Shimada K, Oka N, Takahashi M, Tanuma A, et al. Increased interleukin-1β and basic fibroblast growth factor levels in the cerebrospinal fluid during human herpesvirus-6B (HHV-6B) encephalitis, Biochem Biophys Res Commun. 2017; 486(3):706-711
Wolz MM, Sciallis GF, Pittelkow MR. Human herpesviruses 6, 7, and 8 from a dermatologic perspective, Mayo Clin Proc. 2012; 87(10):1004-14.
Merle NS, Noe R, Halbwachs-Mecarelli L, Fremeaux-Bacchi V, Roumenina LT. Complement System Part II: Role in Immunity, Front Immunol. 2015; 6:257.
Becerra A, Gibson L, Stern LJ, Calvo-Calle JM. Immune response to HHV-6 and implications for immunotherapy, Curr Opin Virol, 2014; 154-61.
De Bolle L, Naesens L, De Clercq E. Update on human herpesvirus 6 biology, clinical features, and therapy, Clin Microbiol Rev. 2005 Jan;18(1):217-45.
Periodismo científico cultural
Sobre el cigarro electrónico
Ya ha pasado tiempo desde que el cigarro se convirtió en el enemigo público número uno, tanto para fumadores como para no fumadores...
[leer mas]
la sal! Tu cerebro
y corazón lo agradecerán
La enfermedad diverticular y sus complicaciones son una causa importante de morbimortalidad en todo el mundo...
[leer mas]
El primer anticuerpo monoclonal para pacientes con hemofilia A e inhibidores a FVIII
Cuando se vive con hemofilia todo puede ser una amenaza para provocar sangrados; desde niños...
[leer mas]
Infografías
TODOS LOS DERECHOS RESERVADOS © SPG COMUNICACIONES SA DE CV 2012-2018
Diseño: A. Victoria Pérez
Aviso de privacidad




