ENFERMEDADES EXANTEMÁTICAS DE LA INFANCIA
FISIOPATOLOGÍA
Parvovirus B19
Parvovirus B19 (PvB19) es una enfermedad común en animales, fue descubierto en humanos hasta 1975 por Cossart y cols., cuando estaban haciendo un análisis a donadores sanguíneos con antígeno para hepatitis (la muestra de suero de uno de los donadores fue codificada B19, de ahí su nombre).
Se ha documentado que por lo menos la mitad, o más, de la población adulta presenta inmunidad a esta enfermedad por la presencia del anticuerpo (inmunoglobulina M específica) para el virus en suero. Además de lo anterior, a través de grandes estudios retrospectivos, se demostró una asociación entre el parvovirus y crisis aplásicas en pacientes con anemia drepanocítica. También se demostró que el PvB19 es el agente etiológico del eritema infeccioso en personas sin patologías hematológicas; se le llamaba originalmente “quinta enfermedad” al ser la quinta de seis enfermedades exantemáticas clásicas descritas de la infancia, pero más recientemente se han documentado infecciones congénitas con abortos de fetos con hidropesía fetal (hydrops fetalis) no inmunes. Se ha estudiado y asociado a otras patologías, pero señalo las importantes para este tema.
Parvovirus B19
El PvB19 es un virus ácido desoxirrubonucléico (ADN) monocatenario de la familia Parvoviridae, género Eritrovirus; tiene un tropismo único para las células progenitoras eritroides humanas. El virus requiere un receptor de antígeno sanguíneo “P” (también conocido como globóside) para ingresar a la célula huesped. Los individuos que carecen del antígeno P son inmunes a la infección por PvB19.
Ocasionalmente, el PvB19 infecta los leucocitos (especialmente neutrófilos), pero no infecta megacariocitos; sin embargo, in vitro, las proteínas B19 del parvovirus tienen un efecto citotóxico sobre los megacariocitos. Aunque la infección por PvB19 puede manifestarse con pancitopenia, no se cree que contribuya significativamente como etiología de una anemia aplástica verdadera.
Infección por Parvovirus B19
El PvB19 tiene un periodo de incubación de 4 hasta 28 días desde la infección inicial, así, puede haber aparición de síntomas inespecíficos desde los días 4 a 14 y hasta 21 días después de la exposición, se caracteriza por eritema maculopapular poco pruriginoso afebril (más detalles en clínica). Es altamente contagioso los días que preceden a la erupción, pacientes con diagnóstico de anemia drepanocítica son contagiosos incluso una semana antes del inicio de los síntomas.
Una vez que el PvB19 se encuentra dentro de la célula huésped, el ADN entra al núcleo; el extremo 3’ de la cadena de ADN se pliega sobre sí formando una horquilla que funciona como autorregulador (self-primer) para la replicación del ADN viral. Las células huésped por las que tienen preferencia tienen un alto índice de replicación (precursores eritroides), particularmente pronormoblastos y normoblastos; por esta característica de la célula huésped y la alta citotoxicidad del PvB19 para la misma, conduce a que exista una supresión de la eritrogénesis durante la infección. No se observan reticulocitos (eritrocitos inmaduros) disponibles para reemplazar los eritrocitos envejecidos o dañados ya que son eliminados por el sistema reticuloendotelial.

Infección congénita y neonatal
Se ha observado que la infección de PvB19, durante el embarazo, puede tener consecuencias nocivas en el feto. Durante la infección fetal se han observado varias características, una de ellas es un daño directo en las células miocárdicas, ya que éstas expresan antígeno “P” que se cree es el origen del daño directo a dichas células. De acuerdo con diferentes estudios prospectivos, el riesgo de muerte fetal y de desarrollo de hidropesía fetal varía entre 0 y 16% y 0 y 12.5%, respectivamente.
Complicaciones
Existe un amplio espectro de síndromes clínicos que se han documentado para la infección de PvB19, el más conocido es el eritema infeccioso (la “quinta enfermedad exantemática de la infancia”), pero, además, en pacientes inmunocomprometidos se manifiesta como crisis aplásicas transitorias por infección persistente expresada como aplasia pura de eritrocitos y artritis. En niños con hemoglobinopatías o con anemia drepanocítica llega a haber un descenso en los niveles de hemoglobina de 2 a 6 g/dL (≤1 usualmente en niños sanos).
En el estudio de Barah y cols., se realizó una revisión sistemática sobre la asociación entre la infección PvB19 y aspectos neurológicos; revisó 129 casos, de 89 publicaciones que incluyeron: publicaciones donde se vinculó el virus con diversos aspectos neurológicos, ya sea confinados al sistema nervioso central (encefalitis y meningitis), ataxia cerebelosa como evento neurológico aislado, enfermedad cerebrovascular, mielitis transversa, convulsiones, síndrome de Reye; además, aquellos relacionados con el sistema nervioso periférico (incluyendo amiotrofia neurálgica, neuropatía periférica, síndrome del túnel carpiano, síndrome de Guillain-Barré). Las manifestaciones neurológicas más asociadas con PvB19 fueron los síndromes encefalíticos, el 38.8% del total de casos neurológicos relacionados con PvB19.
De acuerdo con datos anteriores y análisis de estudios clínicos en niños con anemia drepanocítica, la enfermedad vasculocerebral (EVC) de la infancia es una complicación descrita de la infección por PvB19; en un estudio de Fullerton y cols., donde incluyó 161 muestras de niños con EVC, la mitad de los casos de PvB19 tenían cardiopatía congénita compleja y enfermedad cerebrovascular cardioembólica y media arteriopatía que afectaba un segmento largo de la arteria carótida interna distal. Por lo anterior, describieron la hipótesis de que el PvB19 puede dañar el endotelio cardiaco y arterial, promoviendo trombosis o estenosis arterial.
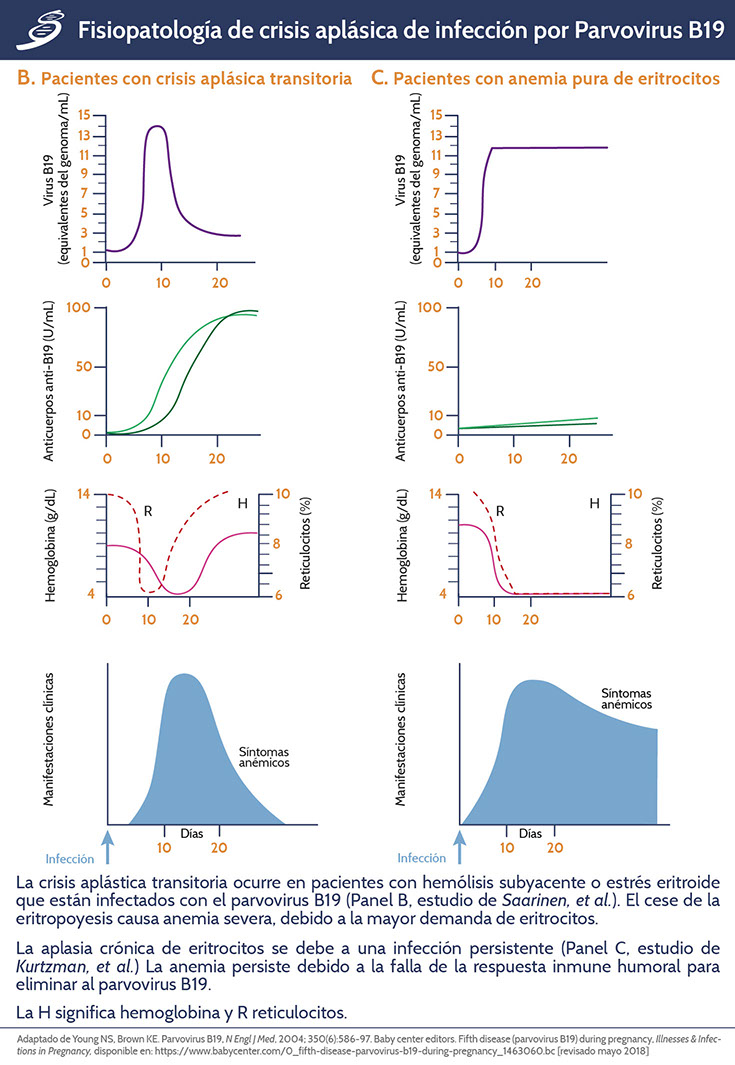
Cronicidad en inmunosupresión
Se ha demostrado que PvB19 es un disparador o desencadenante del desarrollo de varias enfermedades autoinmunes dentro de los rubros de: reumatología, neurología, neuromuscular, cardiovascular, hematología, nefrololgía y endocrinología. La infección por PvB19 produce autoanticuerpos con mecanismos de autoinmunidad, tales como la reacción cruzada de anticuerpos anti-B19 con proteínas humanas, apoptosis inducida por PvB19 que da como resultado la presentación de autoantígenos a linfocitos T y la actividad fosfolipasa de la región de proteína VP1 única de PvB19.
Bibliografía
Pinninti SG. Pediatric Herpes Simplex Virus Infection, Pediatrics: General Medicine [Updated: Dec 14, 2017] disponible: https://emedicine.medscape.com/article/964866-overview [revisado diciembre 2017]
Armangue T, Leypoldt F, Málaga I, Raspall-Chaure M, Marti I, Nichter C, et al. Herpes simplex virus encephalitis is a trigger of brain autoimmunity, Ann Neurol. 2014; 75(2):317-23.
Chayavichitsilp P, Buckwalter JV, Krakowski AC, Friedlander SF. Herpes Simplex, Pediatrics in Review, 2009; VOLUME 30, ISSUE 4:119-130
Enright AM y Prober CG. Neonatal herpes infection: diagnosis, treatment and prevention, Semin Neonatol 2002; 7: 283–291
Freeman ML, Sheridan BS, Bonneau RH y Hendricks RL. Psychological Stress Compromises CD8+ T Cell Control of Latent Herpes Simplex Virus Type 1 Infections, J Immunol, 2007; 179(1): 322–328.
Peng T, Zhu J, Klock A, Phasouk K, Huang ML, Koelle DM, et al. Evasion of the mucosal innate immune system by herpes simplex virus type 2, J Virol. 2009; 83(23):12559-68.
Sanders JE, Garcia SE. Pediatric herpes simplex virus infections: an evidence-based approach to treatment, Pediatr Emerg Med Pract, 2014; 11(1):1-19; quiz 19.
Schiffer JT, Corey L. Rapid host immune response and viral dynamics in herpes simplex virus-2 infection, Nat Med. 2013; 19(3):280-90.
Schleede L, Bueter W, Baumgartner-Sigl S, Opladen T, Weigt-Usinger K, Stephan S, et al. Pediatric herpes simplex virus encephalitis: a retrospective multicenter experience, J Child Neurol, 2013; 28(3):321-31.
Wang JP, Bowen GN, Zhou S, Cerny A, Zacharia A, Knipe DM, et al. Role of specific innate immune responses in herpes simplex virus infection of the central nervous system, J Virol. 2012; 86(4):2273-81.
Periodismo científico cultural
Sobre el cigarro electrónico
Ya ha pasado tiempo desde que el cigarro se convirtió en el enemigo público número uno, tanto para fumadores como para no fumadores...
[leer mas]
la sal! Tu cerebro
y corazón lo agradecerán
La enfermedad diverticular y sus complicaciones son una causa importante de morbimortalidad en todo el mundo...
[leer mas]
El primer anticuerpo monoclonal para pacientes con hemofilia A e inhibidores a FVIII
Cuando se vive con hemofilia todo puede ser una amenaza para provocar sangrados; desde niños...
[leer mas]
Infografías
TODOS LOS DERECHOS RESERVADOS © SPG COMUNICACIONES SA DE CV 2012-2018
Diseño: A. Victoria Pérez
Aviso de privacidad




