ENFERMEDADES EXANTEMÁTICAS DE LA INFANCIA
FISIOPATOLOGÍA
Herpes
El virus del herpes simple (VHS) tiene un amplio rango de manifestaciones clínicas en los humanos, desde la forma intrauterina, neonatal, en la infancia y hasta la vida adulta; después del periodo neonatal, la mayoría de las infecciones primarias son por VHS tipo 1 (VHS-1), principalmente en la infancia a través del contacto con mucosas y saliva infectada. Las infecciones primarias de VHS tipo 2 (VHS-2) usualmente son adquiridas en un contexto de actividad sexual.
Virus del herpes simple
El VHS es un virus ácido desoxirrubonucléico (ADN) de doble cadena de la familia Herpesviridae, subfamilia Alphaherpesvirinae; hay más de 80 tipos de herpesvirus, ocho de los cuales son capaces de infectar a los humanos. Tiene un rango de incubación para enfermedad primaria por VHS-1 o VHS-2 de 2 a 12 días; después de esta infección primaria, hay una fase de replicación que puede durar desde una hasta varias semanas. El VHS-1 tiende a permanecer en los ganglios trigeminales, el VHS-2 comúnmente se ubica en los ganglios sacros. Mientras está en los ganglios basales, el virus puede replicarse sin ser detectado por el sistema inmune del huésped. Aunque las secuencias de ADN de VHS-1 y VHS-2 son muy similares, las proteínas internas de la envoltura permiten la distinción serológica entre las dos.
Infección por VHS
Para el caso de la infección primaria se tomará como ejemplo, para VHS, la descripción del VHS-2. La infección comienza con el contacto del virus en las células nucleadas en la capa basal de la epidermis a través de brechas microscópicas. El ciclo de replicación del VHS se rige por medio de procesos que promueven la transcripción del ADN viral, la traducción del ácido ribonucleico mensajero (ARNm), la replicación del ADN, el ensamblaje viral y la salida viral antes de que ocurra lisis celular con estrategias de evasión inmune. La replicación viral conduce a la muerte de los queratinocitos, después de la entrada al citosol, se produce proteína viral en forma de cascada. Primero, productos génicos tempranos se producen para promover la evasión inmune, neurovirulencia y proteínas requeridas para la replicación de ADN. De manera secundaria, las proteínas que se producen son para los componentes estructurales de la cápside para la salida de los viriones. El intervalo que transcurre entre la entrada del virus y la lisis celular es de 24 hrs aproximadamente. Si nada interfiere en su historia natural, el VHS se propaga entre las células epiteliales para conducir a la formación de úlceras/vesículas; después, entra en los axones neuronales sensoriales a través de las terminaciones nerviosas libres de la epidermis y se transporta a los cuerpos celulares neuronales en los ganglios de la raíz dorsal, donde se replica y se propaga a otras neuronas.
En algunos individuos, cuando ocurre una reactivación del VHS latente resulta en su transporte anterógrado a la periferia y liberación de viriones infecciosos en la piel o las superficies de la mucosa. Para dicha reactivación, se ha propuesto un modelo matemático que asumió que los ganglios de las raíces dorsales liberan pequeñas cantidades de virus de forma casi constante (10-100 copias de ADN de VHS-2 por día); como si fuera una especie de "goteo viral lento" que está de acuerdo con observaciones realizadas en las cuales el 6.3% de los cuerpos celulares neuronales, en los ganglios del trigémino humano, albergan ADN de VHS-1, mientras que sólo el 0.6% contiene >100 copias de ADN de VHS-1. Muchos cuerpos celulares neuronales infectados están rodeados por células T del huésped por la forma latente de la infección neuronal. La amplia distribución anatómica de los viriones de reactivación da lugar a una exposición antigénica frecuente (véase el siguiente esquema).
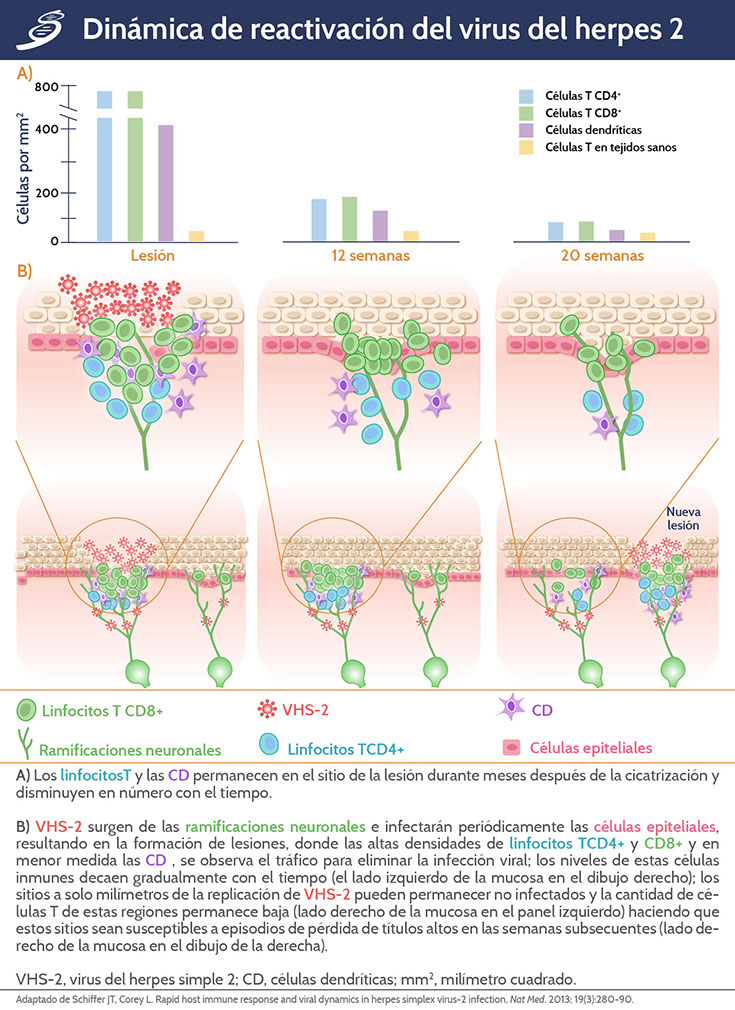
El VHS se libera de forma continua y lenta debido a la reactivación simultánea dentro de múltiples ganglios. Esto conduce a la liberación de VHS en mucosas. Periódicamente, las células epiteliales se infectan, lo que provoca una rápida diseminación viral, múltiples células infectadas, formación de microrredes o úlceras (donde se lisa un alto número de queratinocitos y se desprenden viriones) y una gran infiltración de linfocitos T CD4+ y CD8+. Después del intento de contención de VHS de forma localizada en un sólo sitio, las células T permanecen en esta ubicación durante varios meses en un papel de inmunovigilancia. El VHS-2 se reactiva en otros sitios donde la densidad de linfocitos TCD4+ y CD8+ es menor, lo que permite un episodio de diseminación del tracto genital, que se inicia en una región diferente.
Papel de la inmunidad en la infección
La inmunidad mediada por células y por anticuerpos influyen en la gravedad de la infección por VHS, así como también en la frecuencia de futuras recurrencias; la interacción entre los virus y las células del huésped son fundamentales para determinar el resultado de las infecciones. Los factores inmunológicos específicos no se conocen por completo, se cree que uno de sus mecanismos durante las infecciones es suprimir la inmunidad innata inhibiendo la producción de interferón-alfa (IFN-α) e interferón-beta (IFN-β).
Por medio de estudios de investigación básica y clínica, se ha demostrado que el VHS-1 puede desencadenar a los receptores tipo Toll (TLRs) para inducir la producción de citocinas. Se han descrito señales dependientes de TLR2 en la infección por VHS-1 y el reconocimiento del ADN genómico del VHS, ya que VHS-1 y VHS-2 estimulan la producción de citocinas en células dendríticas plasmáticas de manera dependiente de TLR9 y VHS-1 que, junto con IFN-β, induce citocinas a través de la vía PYHIN (familia de genes) por la proteína activadora transcripcional de la diferenciación mieloide inducible por interferón (IFI16). Unc-93 homolog B1 (UNC93B1) es una proteína de membrana residente en el retículo endoplásmico (RE) que se requiere para la señalización a través de TLR3, TLR7 y TLR9, ya que permite que estos TLR se transloquen del RE al compartimento endolisosómico. La deficiencia de UNC93B1 se asocia con encefalitis por herpes esporádica en humanos, que podría tener relación con el deterioro de las respuestas celulares de IFN tipo I y tipo III después de una infección viral.
Además de casos de inmunosupresión, con base en investigaciones, se cree que la exposición al estrés es un desencadenante de la reactivación de VHS-1, esto se ha sustentado también por la evidencia del compromiso en la función de los linfocitos T CD8+ posterior a estrés físico o psicológico.
Infección congénita
La infección congénita de VHS predominantemente es causada por VHS-2 en el feto previo al nacimiento, en su mayoría los fetos infectados mueren en el útero. Si llegan a sobrevivir, generalmente presentan lesiones vesiculares, alteraciones del sistema nervioso central como microcefalia, microftalmia, coriorretinitis, entro otros.
Se reconoce a la infección neonatal por la aparición de las vesículas de 10 a 20 días después del nacimiento. La forma más común de contagio es por herpes genital recurrente durante el embarazo; sin embargo, las mujeres con infección primaria por herpes genital tienen mayor riesgo de trasmitirlo al feto. Otro factor importante para la transmisión vertical es el tiempo que transcurre entre la ruptura de las membranas de la madre y el nacimiento.
Complicaciones
Las complicaciones ocurren cuando el huésped (especialmente neonatos e inmunocomprometidos) no pueden controlar la fase de replicación viral. Secundario a la deficiencia inmunitaria de cualquier índole, la viremia puede invadir pulmones, hígado, glándulas suprarrenales y afectar o no al sistema nervioso central.
Una de las complicaciones más comunes por VHS es la encefalitis, en la cual, las neuronas se destruyen a través de procesos líticos y hemorrágicos que tienen predilección por los lóbulos temporales. Aproximadamente, en un tercio de los casos, la encefalitis por herpes es el resultado de una infección primaria de VHS, mientras que los otros dos tercios son secundarios a la reactivación del virus.
El VHS-1 es un agente etiológico aislado principalmente en infecciones de adultos e infantes, mientras que el VHS-2 se detecta en neonatos. En los infantes, la encefalitis por VHS típicamente afecta lóbulos temporales, ínsulas y el cíngulo de forma asimétrica, mientras que, en los neonatos, comúnmente se observan lesiones multifocales.
También se han reportado casos de encefalitis autoinmune posterior a infección por VHS con anticuerpos anti-receptor N-metil-D-aspartato; puede ocurrir por contigüidad o unas semanas después de la infección de VHS, ya que el virus es un disparador de autoinmunidad sináptica/células de superficie.
Bibliografía
Cennimo DJ. Parvovirus B19 Infection, Pediatrics: General Medicine [Updated: Oct 30, 2017] disponible en:
https://emedicine.medscape.com/article/961063-overview#a5 [revisado diciembre 2017]
Barah F, Whiteside S, Batista S y Morris J. Neurological aspects of human parvovirus B19 infection: a systematic review, Rev Med Virol, 2014; 24(3): 154–168.
Enders M, Weidner A, Zoellner I, Searle K, Enders G. Fetal morbidity and mortality after acute human parvovirus B19 infection in pregnancy: prospective evaluation of 1018 cases, Prenat Diagn, 2004; 24(7):513-8.
Fullerton HJ, Luna JM, Wintermark M, Hills NK, Tokarz R, Li Y, et al. Parvovirus B19 Infection in Children With Arterial Ischemic Stroke, Stroke, 2017; 48(10):2875-2877.
Gallinella G. Parvovirus B19: recent insights and implications for pathogenesis, diagnosis and therapy, Microbiología Médica, 2017; Volume32:7109.
Kerr JR. The role of parvovirus B19 in the pathogenesis of autoimmunity and autoimmune disease, J Clin Pathol. 2016; 69(4):279-91.
Vafaie J y Schwartz RA. Parvovirus B19 infections, International Journal of Dermatology, 2004; 43, 747–749.
Young NS, Brown KE. Parvovirus B19, N Engl J Med, 2004; 350(6):586-97.
Periodismo científico cultural
Sobre el cigarro electrónico
Ya ha pasado tiempo desde que el cigarro se convirtió en el enemigo público número uno, tanto para fumadores como para no fumadores...
[leer mas]
la sal! Tu cerebro
y corazón lo agradecerán
La enfermedad diverticular y sus complicaciones son una causa importante de morbimortalidad en todo el mundo...
[leer mas]
El primer anticuerpo monoclonal para pacientes con hemofilia A e inhibidores a FVIII
Cuando se vive con hemofilia todo puede ser una amenaza para provocar sangrados; desde niños...
[leer mas]
Infografías
TODOS LOS DERECHOS RESERVADOS © SPG COMUNICACIONES SA DE CV 2012-2018
Diseño: A. Victoria Pérez
Aviso de privacidad




