ESCLEROSIS MÚLTIPLE
FISIOPATOLOGÍA
Esclerosis Múltiple (EM) es una enfermedad neurodegenerativa progresiva, con un mecanismo patológico autoinmune, implicando células T autoreactivas específicas de mielina no anérgica, activadas en el sistema inmune periférico a través de interacción con desencadentantes ambientales y suceptibilidad genética. Dicha actividad inmunológica culmina en desmielinización y daño axonal del sistema nervioso central (SNC).
La EM se presenta de manera heterogénea, al ser así varían sus presentaciones desde alteraciones sensoriales, visuales, motoras, neuralgia, hasta déficit cognitivo. Esto se correlaciona y se personaliza para cada paciente de acuerdo a la ubicación espaciotemporal de los sitios de lesión en el SNC. Las lesiones son causadas por infiltración inmunitaria a través de la barrera hematoencefálica (BHE) que promueve la inflamación, desmielinización, gliosis y degeneración neuroaxonal.
Lesiones desmielinizantes en placa
Abordando primero macroscópicamente la EM, el daño a SNC produce lesiones en placa sobre las neuronas, clasificadas de acuerdo a su progresión temporal, etapa de la enfermedad o destrucción inflamatoria.
Lesiones tempranas (agudas)
Se caracterizan por infiltración inflamatoria de células combinada con desmielinización distribuida en la lesión. Este tipo de lesión tiene márgenes mal definidos, células inmunitarias infiltradas alrededor de los vasos como linfocitos (predominantemente células T), monocitos, macrófagos “espumosos” que participan activamente en la eliminación de mielina, y edema parenquimnatoso. El grado de pérdida de oligodendrocitos (ODCs) en las lesiones es variable, la lesión axonal puede ser extensa, observándose reactividad glial a lo largo de la misma, especialmente astrocitos hipertróficos.
Lesiones crónicas
Se caracteriza por una región de hipocelularidad con pérdida de mielina y cicatrización glial; las placas con lesiones crónicas se dividen de acuerdo a la evolución temporal de la destrucción activa en el borde de la lesión:
- Placa crónica activa: histológicamente existe inflamación activa a lo largo del borde exterior semejante al que se observa en lesiones agudas; así, en el borde se observan células de la microglía y macrófagos activados, células inmunológicas perivasculares y astrocitos reactivos. Hay presencia de anticuerpos y células del complemento además de áreas de remielinización; en el núcleo de la placa hay hipocelularidad, sin embargo, puede contener vasos engrosados con espacios perivasculares agrandados.
- Placa crónica silente: estas lesiones se caracterizan histológicamente por pérdida de los rasgos inflamatorios en sus bordes, son infrecuentes las áreas de remielinización y células progenitoras de ODCs. Existe además una pérdida completa de ODCs, reducción variable de densidad axonal y una región cicatrizada de desmielinización.
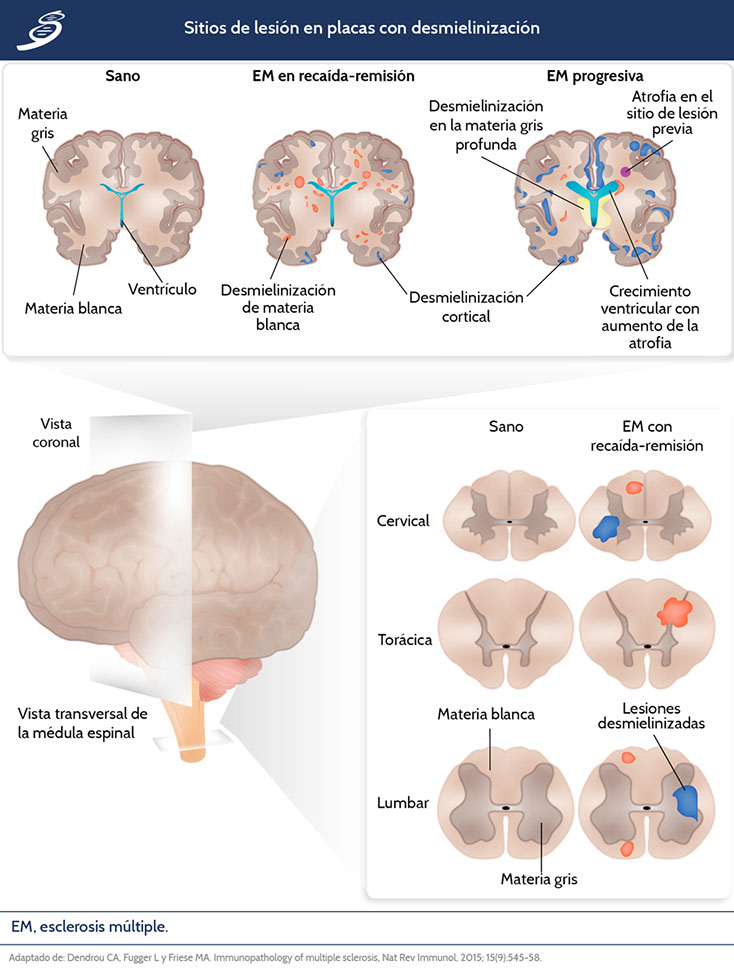
Las lesiones situadas en la corteza cortical por la desmielinización y neurodegeneración secundaria, se correlacionan con la disfunción cognitiva y progresión de la EM. Para las placas corticales también se han descrito tres tipos según su localización:
- Lesiones leucocorticales: se extienden desde la sustancia blanca hasta la corteza.
- Lesiones intracorticales: se proyectan radialmente desde microvasos.
- Lesiones subpiales: se extienden intracorticamente desde la pia madre; las placas subpiales de tipo banda desmielinizadas a menudo implican giros contiguos, favoreciendo la lesión de aquellas regiones del cerebro dedicadas a la atención y procesamiento de la memoria.
Desregulación del sistema inmune fuera del SNC
Existe un mecanismo fisiológico normal de regulación inmunológica, especialmente para las células T. El proceso de regulación activa de las células T comienza en el timo, la mayoría de las células T autorreactivas son eliminadas; sin embargo, algunas de las células T autorreactivas logran ser liberadas a la circulación periférica. A pesar de lo anterior, los mecanismos de tolerancia periférica mantienen estas células bajo control por medio de las células T reguladoras (Treg). Si el equilibrio de dicho proceso de selección se rompe, ya sea por disminución en la función de las células Treg, o por aumento en la resistencia de células T y B efectoras a los mecanismos supresores.
Hasta ahora no se ha definido si existe un factor exógeno conocido, por lo que la EM podría ser desencadenada en la periferia o en el SNC. Existe un modelo extrínseco del SNC que considera la activación de las células T autorreactivas en la periferia, por medio de mimetismo molecular, alguna célula circulante o la coexpresión de receptores de células T (TCR) con diferente especificidad. Así también, las células B autorreactivas se convierten en células efectoras por mimetismo molecular, presentación de un nuevo autoantígeno, reconocimiento de un antígeno secuestrado de SNC o activado por otra célula. Se cree que diferentes factores genéticos y ambientales, tales como agentes infecciosos y constituyentes de humo, contribuyen a estos eventos.
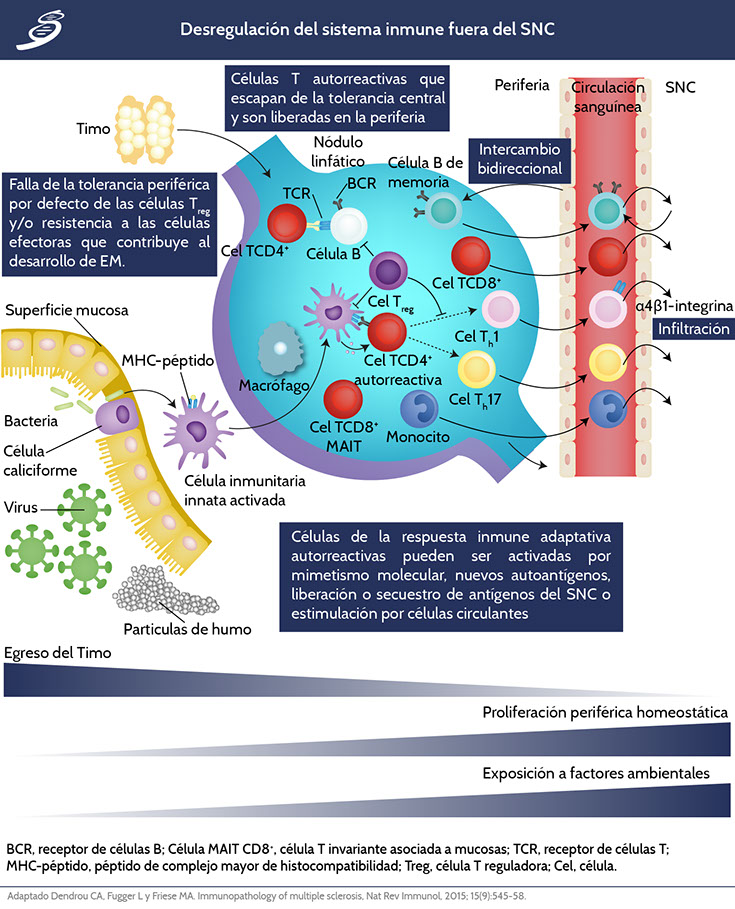
Al ser activados, los linfocitos TCD8+, linfocitos TCD4+ diferenciados en TCD4+helper 1 (Th1) y Th17, células B y células del sistema inmune innato, pueden infiltrarse al SNC causando inflamación y daño tisular. El tráfico de células B fuera del SNC puede experimentar maduración de afinidad en los ganglios linfáticos antes de volver a entrar en el órgano diana y promover un mayor daño. Las flechas marcadas indican diferenciación (Como se observa en la imagen anterior).
Se cree que no existe un aislamiento absoluto del SNC del sistema inmune, el SNC ha sido considerado como un promotor de la iniciación periférica de respuestas inmunes adaptativas contra antígenos del SNC con la consiguiente infiltración de la BHE. Aún en individuos sanos, las células T de memoria circulan a través del líquido cefalorraquídeo (LCR), lo que indica la posibilidad para la vigilancia inmune intrínseca del SNC.
Las células del sistema inmune innato que se encuentran en la circulación de los espacios meníngeos perivasculares y ventriculares, pueden funcionar como células presentadoras de antígenos para las células T circulantes a través del LCR y así, activar a las células T restringidas a antígenos de SNC en condiciones inflamatorias.
Proceso degenerativo secundario a inflamación crónica
El proceso neurodegenerativo crónico de la EM y la inflmación crónica dan como resultado la producción de especies reactivas de oxígeno (ROS), además especies reactivas de nitrógeno (RNS), las cuales, al acumularse, promueven lesiones mitocondriales y nuevas mutaciones para el ácido desoxirribonucleico (ADN) mitocondrial. Esto genera un círculo vicioso en el que el estrés metabólico, los errores en el repliegue de las proteínas en el retículo endoplasmático, deficiencia energética alteran la función neuroaxonal, que es altamente demandante de energía.
La cascada de eventos también genera una redistribución compensatoria de varios canales iónicos a lo largo de las neuronas desmielinizadas con el propósito de mantener la homeostasis iónica; sin embargo, esta redistribución, además de la acumulación excesiva de glutamato (principal neurotransmisor excitador del SNC), promueve el desequilibrio iónico que causa daño tisular.
Estos mecanismos degenerativos pueden propagarse desde el sitio de lesión axonal hacia el cuerpo celular neuronal (de manera retrógada o “muerte neuronal”) o hacia la terminal distal del axón (denominado degeneración anterógrada o Walleriana) pudiendo influir también en neuronas presinápticas cercanas o postsinápticas, conduciendo a apoptosis o necrosis neuronal.
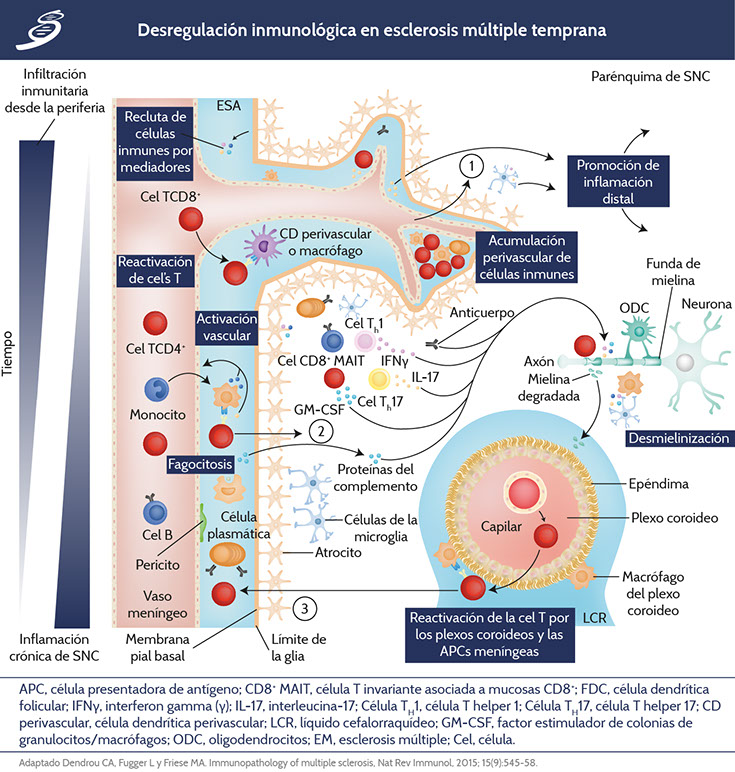
Inmunopatología dentro del SNC en esclerosis múltiple temprana y tardía
EM temprana
La infiltración inmunitaria periférica ocurre desde los vasos sanguíneos meníngeos que cruzan la BHE (Imagen con inciso «1»), desde el espacio subaracnoideo (ESA) (Imagen con inciso «2») o desde los plexos coroideos por el contacto con el LCR (Imagen con inciso «3»). Las células de la inmunidad innata se acumulan en los espacios perivasculares entrando en el parénquima del SNC. Estas células, aunadas a los astrocitos y células de la microglía activadas, favorecen la desmielinización y lesión neuroaxonal de ODCs por los mecanismos mecionados previamente.
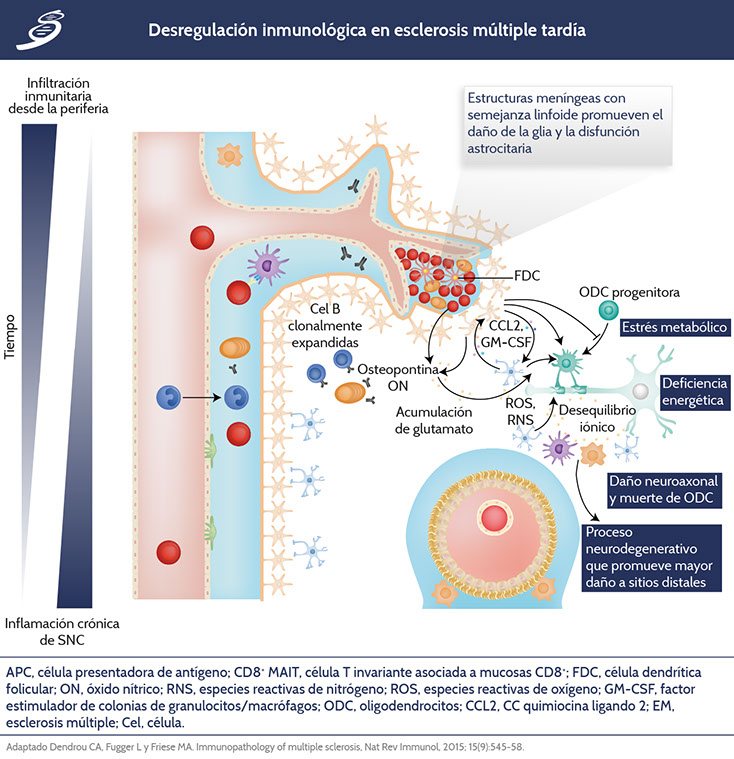
EM tardía
En un escenario crónico, la infiltración de células disminuye por probable agotamiento adaptativo; sin embargo, la inflamación crónica del parénquima y la neurodegeneración continúan avanzando. Se han documentado estructuras meníngeas con semejanza linfoide en enfermedad progresiva secundaria que contribuyen a la inflamación tardía. Además, las células de la microglía estimulan a los astrocitos que pueden llegar a producir CC-quimiocina ligando 2 (CCL2), factor estimulante de colonias de granulocitos y macrófagos (GM-CSF), así como inhibir la maduración de células progenitoras de ODCs, causando mayor reclutamiento, activación de células de la microglía y evitando la remielinización (Como se observa en la siguiente imagen).
Bibliografía
Dendrou CA, Fugger L y Friese MA. Immunopathology of multiple sclerosis, Nat Rev Immunol, 2015; 15(9):545-58.
Gold R, Wolinsky JS. Pathophysiology of multiple sclerosis and the place of teriflunomide, Acta Neurol Scand, 2011; 124: 75–84.
Wu GF y Alvarez E. The immuno-pathophysiology of multiple sclerosis, Neurol Clin. 2011; 29(2): 257–278.
Lucchinetti CF, Popescu BFG, Bunyan RF, Moll NM, Roemer SF, Lassmann H, et al. Inflammatory Cortical Demyelination in Early Multiple Sclerosis, N Engl J Med, 2011; 365:2188-97.
Periodismo científico cultural
Sobre el cigarro electrónico
Ya ha pasado tiempo desde que el cigarro se convirtió en el enemigo público número uno, tanto para fumadores como para no fumadores...
[leer mas]
la sal! Tu cerebro
y corazón lo agradecerán
La enfermedad diverticular y sus complicaciones son una causa importante de morbimortalidad en todo el mundo...
[leer mas]
El primer anticuerpo monoclonal para pacientes con hemofilia A e inhibidores a FVIII
Cuando se vive con hemofilia todo puede ser una amenaza para provocar sangrados; desde niños...
[leer mas]
Infografías
TODOS LOS DERECHOS RESERVADOS © SPG COMUNICACIONES SA DE CV 2012-2018
Diseño: A. Victoria Pérez
Aviso de privacidad




