MONONUCLEOSIS INFECCIOSA
FISIOPATOLOGÍA
El nombre de mononucleosis infecciosa (también llamada enfermedad del beso), fue acuñado por Sprunt y Evans (Sprunt 1920) para describir un síndrome que se asemejaba a una enfermedad infecciosa aguda acompañada de linfocitos atípicos de sangre periférica, también conocidos como células de Downey (Downey 1923 describió linfocitos T CD8+ activados que responden a células infectadas); esta enfermedad es causada por el virus del Epstein-Barr (VEB), el cual está clasificado como un γ-herpes virus con un ácido desoxirribonucléico (ADN) lineal.
Más del 90% de la población mundial en la edad adulta ya ha sido infectado; la primera exposición suele ser en la adolescencia a través del intercambio de saliva o su contacto en el ambiente, si la infección no se vuelve silente (es decir, que no se expresa clínicamente) podrían ser portadores, si se expresa, se experimenta la mononucleosis infecciosa.
Virus del Epstein-Barr
El EBV requiere pasos secuenciales para la síntesis de proteínas virales; las primeras que se expresan sirven como “transactivadoras” mejorando la síntesis de proteínas requeridas para la replicación. Los principales transactivadores son Zta y Rta que actúan al inicio de la replicación, las células que pueden ser infectadas principalmente son las epiteliales y linfoides. Los primeros transactivadores inmediatos incluyen la proteína BNLF2 que sirve en la replicación, metabolismo y bloqueo de procesamiento de antígenos, además los productos génicos tardíos que expresan proteínas virales estructurales como la cápside y la proteína BCRF1, que ayuda al virus a escapar de la respuesta inmune del huésped.
Para la entrada a los linfocitos B, utiliza una proteína de unión viral (VAP o también llamada gp350), el cual, se une a la membrana celular por medio de CD21, adicionalmente, otra proteína viral llamada gp42 que se une en la superficie celular al complejo mayor de histocompatibilidad clase II (MHC II). Estas interacciones permiten que la envoltura viral se fusione entrando así al linfocito B. En el caso de las células epiteliales, la proteína viral BMRF-2 interactúa con las integrinas β1 de la membrana celular, y las proteínas virales gH y gL interactúan con las integrinas αvβ6/8 celulares; estos dos procesos mejoran la fusión entre la membrana celular epitelial y la envoltura viral. Ya en la célula huésped, el VEB descubre su ADN para transportarlo al núcleo; en ambas células, antes descritas, el VEB puede experimentar un ciclo de replicación lítica, produciendo así viriones.
Existen dos cepas de VEB llamadas VEB-1 y VEB-2 (también conocidas como tipo A y B), entre las cuales existen algunas diferencias en la expresión génica, pero en la infección primaria no difieren ni tampoco en su prevalencia, incluso, pueden infectar de manera simultánea al mismo huésped.
Infección por VEB
Después de existir una inoculación inicial, el virus en su infección primaria se replica en las células epiteliales nasofaríngeas, causando una liberación de viriones que se diseminan a estructuras contiguas, las cuales incluyen glándulas salivales y tejidos linfoides orofaríngeos. La replicación viral adicional produce una infección al sistema linforreticular, que incluye el hígado, el bazo y los linfocitos B en la sangre periférica.
El virus así circula por el cuerpo a través de las células B infectadas; dentro de estas células, el EBV puede conducir a una serie de ciclos de replicación lítica o puede mostrar una expresión diferencial de los genes latentes que permitirá al virus volverse latente en las células. Como resultado de la replicación continua del virus, también puede permanecer latente en el sistema linforreticular.
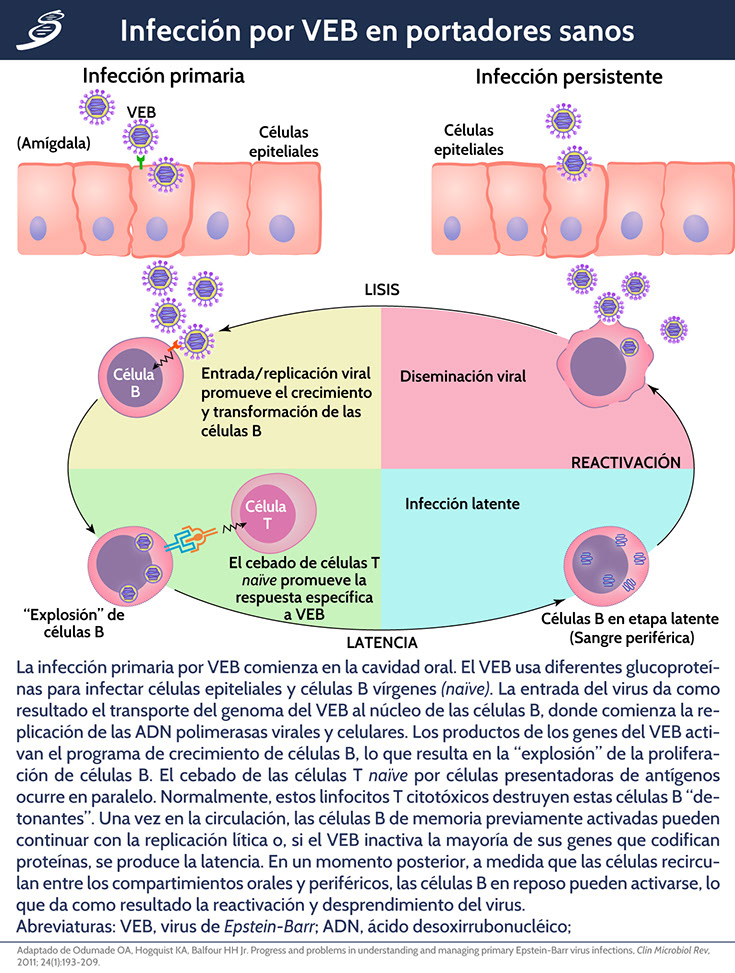
Papel de la inmunidad en la infección
Los linfocitos T CD8+ llevan a cabo funciones supresoras y citotóxicas como respuesta a la infección viral hacia los linfocitos atípicos, eventualmente se reduce el número de linfocitos B infectados por VEB a menos de 1 por 106 células B circulantes. Durante la infección activa de mononucleosis infecciosa, cuando hay un número muy elevado de linfocitos T CD8+ circulantes, muchas son hacia proteínas expresadas de forma lítica específicas y dirigidas hacia las primeras proteínas en etapas tempranas y proteínas de etapas inmediatas del ciclo lítico.
Ambos tipos de linfocitos, tanto células T CD8+ como CD4+ requieren un contacto de célula a célula para activarse y realizar las funciones relacionadas; las cifras totales de linfocitos T CD4+ no aumentan de forma considerable, pero hay evidencia que respalda el concepto de que las células T CD4+ están activadas y ayudan a controlar las células B infectadas. Las respuestas de las células T CD4+ a EBNA1 no se desarrollan hasta mucho más tarde, lo que probablemente explica el retraso en la respuesta de anticuerpos IgG anti-EBNA1.
Cronicidad
La replicación lítica del EBV en las células B se observa generalmente después de la reactivación del virus latente, mientras que en las células epiteliales se ha observado que ocurre directamente en la infección primaria después de la entrada del virus a la célula; el genoma latente circular del VEB adopta una forma lineal después de la reactivación para adoptar el ciclo de replicación lítica. La reactivación espontánea puede ocurrir en las células infectadas de forma latente, lo que lleva a la diseminación del virus.
Cuando existe una infección latente, hay tres patrones de expresión para las proteínas celulares:
• Latencia de tipo I: asociada con el linfoma de Burkitt, se caracteriza sólo por la expresión de ácidos ribonucleicos (ARNs) codificados por el VEB, regiones tempranas de VEB (EBER y antígeno nuclear 1 de VEB [EBNA1]).
• Latencia tipo II: Se caracteriza por la expresión de tres proteínas de membrana latentes LMP1, LMP2A y LMP2B, además de EBERs y EBNA1; está asociado a carcinoma nasofaríngeo.
• Latencia tipo III: es un patrón que se encuentra generalmente en células de individuos sanos con infección latente. Además de los EBER y EBNA1, expresados en latencia de tipo I, otros antígenos nucleares (que incluyen EBNA2, EBNA3A, EBNA3B, EBNA3C y LMP) se pueden expresar en la latencia tipo III.
Bibliografía
Bennett NJ. Pediatric Mononucleosis and Epstein-Barr Virus Infection, Pediatrics: General Medicine, [Updated: Nov 02, 2017], disponible en: https://emedicine.medscape.com/article/963894-overview [revisado diciembre 2017]
Ali AS, Al-Shraim M, Al-Hakami AM, Jones IM. Epstein- Barr Virus: Clinical and Epidemiological Revisits and Genetic Basis of Oncogenesis, Open Virol J. 2015 Nov 3;9:7-28.
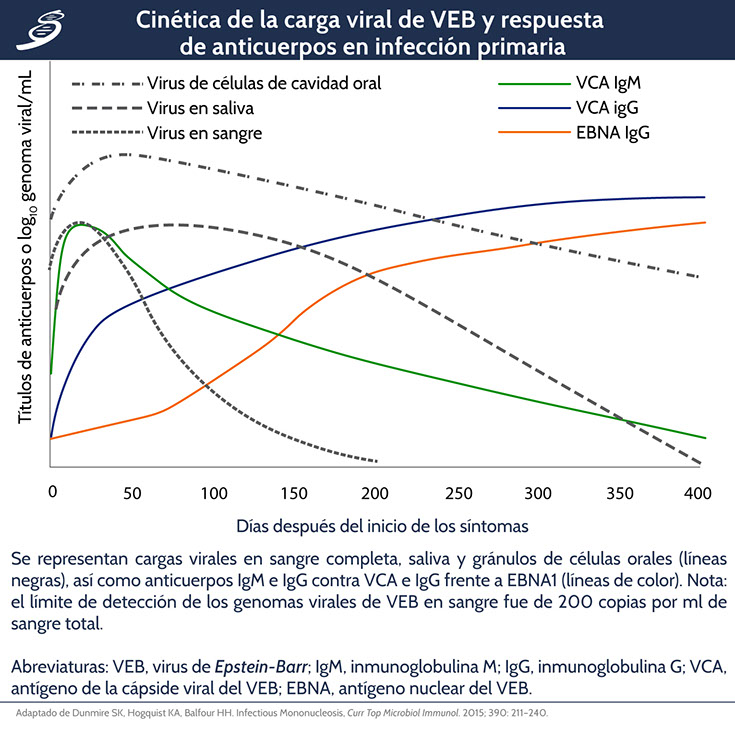
Dunmire SK, Hogquist KA, Balfour HH. Infectious Mononucleosis, Curr Top Microbiol Immunol. 2015; 390: 211–240.
Levin LI, Munger KL, O'Reilly EJ, Falk KI, Ascherio A. Primary infection with the Epstein-Barr virus and risk of multiple sclerosis, Ann Neurol, 2010; 67(6):824-30.
Odumade OA, Hogquist KA, Balfour HH Jr. Progress and problems in understanding and managing primary Epstein-Barr virus infections, Clin Microbiol Rev, 2011; 24(1):193-209.
Periodismo científico cultural
Sobre el cigarro electrónico
Ya ha pasado tiempo desde que el cigarro se convirtió en el enemigo público número uno, tanto para fumadores como para no fumadores...
[leer mas]
la sal! Tu cerebro
y corazón lo agradecerán
La enfermedad diverticular y sus complicaciones son una causa importante de morbimortalidad en todo el mundo...
[leer mas]
El primer anticuerpo monoclonal para pacientes con hemofilia A e inhibidores a FVIII
Cuando se vive con hemofilia todo puede ser una amenaza para provocar sangrados; desde niños...
[leer mas]
Infografías
TODOS LOS DERECHOS RESERVADOS © SPG COMUNICACIONES SA DE CV 2012-2018
Diseño: A. Victoria Pérez
Aviso de privacidad




