CÁNCER DE ESTÓMAGO
Aspectos moleculares del cáncer de estómago
El cáncer de estómago se refiere a cualquier neoplasia maligna que surge de la región que se extiende entre la unión gastroesofágica y el píloro. Aproximadamente el 95% de los tumores de estómago son de origen epitelial y designados como adenocarcinomas, sin embargo, son raros los carcinomas adenoescamosos, escamosos e indiferenciados. La Organización Mundial de la Salud y el sistema de clasificación de Lauren han descrito dos tipos histológicos de cáncer gástrico que son clínicamente y epidemiológicamente entidades distintas: intestinales y difusas (Figura 1). El tipo intestinal bien diferenciado, que contiene células neoplásicas cohesivas, forma estructuras tubulares similares a las glándulas que frecuentemente se ulceran, mientras que el tipo difuso poco diferenciado se caracteriza por la infiltración y el engrosamiento de la pared del estómago sin aparición de una masa discreta. El tipo intestinal es más común en los hombres, principalmente en personas mayores, aunque también se ha reportado en pacientes afroamericanos, demostrando un mejor pronóstico. Este tipo de cáncer proviene de lesiones precancerosas como atrofia gástrica y metaplasia intestinal, y está influenciada por factores ambientales como la infección por H. pylori, obesidad y factores dietéticos. El tipo difuso representa el tipo histológico más frecuente en mujeres y pacientes más jóvenes, y está asociado con el grupo sanguíneo A, lo que indica susceptibilidad genética; además, se han identificado carcinomas gástricos mixtos compuestos por componentes intestinales y difusos.
El desarrollo de carcinoma gástrico invasivo implica una evolución escalonada a través de una cascada de lesiones precancerosas. Se producen cambios histopatológicos secuenciales en la mucosa gástrica incluyendo gastritis atrófica con pérdida de masa de células parietales, metaplasia intestinal y displasia que eventualmente conducen a carcinoma. La secuencia metaplasia/displasia/ carcinoma es más relevante para el tipo de cáncer gástrico intestinal que se desarrolla por una serie acumulativa de alteraciones genéticas similares a las del cáncer colorrectal.
ALTERACIONES GENÉTICAS EN EL CÁNCER DE ESTÓMAGO
El desarrollo del cáncer gástrico es un proceso complejo y de varias etapas que implica múltiples alteraciones genéticas y epigenéticas en oncogenes, genes supresores de tumores, genes de reparación del ADN, reguladores del ciclo celular y moléculas de señalización. Se ha sugerido que un promedio de 4.18 alteraciones genómicas son necesarias para el desarrollo del cáncer gástrico. Otro aspecto importante es que el carcinoma gástrico se caracteriza por la inestabilidad genómica que podría ser inestabilidad de microsatélites (MSI) o inestabilidad cromosómica (CIN).
Inestabilidad cromosómica (CIN)
CIN, reconocido como la inestabilidad más común que ocurre en tumores gástricos esporádicos, puede manifestarse como ganancia o pérdida de cromosomas enteros (aneuploidía) o partes de cromosomas (pérdida de heterocigosidad [LOH], translocaciones y amplificaciones). El análisis de hibridación genómica comparativa ha revelado diversas variaciones del número de copias de ADN con ganancias en las regiones cromosómicas 6p21, 9p34, 11q23, 17p13, 19p13 y 22q13, especialmente en pacientes más jóvenes, demostrándose también variaciones del número de copias de ADN en pacientes con cáncer gástrico con una alta frecuencia de ganancia cromosómica 20q13, así como la regulación positiva de 114 genes candidatos en las regiones de amplificación y la regulación negativa de 11 genes en las regiones de deleción.
Se cree que LOH en los cromosomas 1p, 2q, 3p, 4p, 5q, 6p, 7p, 7q, 8p, 9p, 11q, 12q, 13q, 14q, 17p, 18q, 21q y 22q, que son sitios posibles de genes supresores de tumores, juega un papel crucial en la carcinogénesis gástrica. Se han sugerido varios factores para contribuir a CIN en pacientes con cáncer gástrico, incluyendo aberraciones en la segregación cromosómica, daños en el ADN, regulación del ciclo celular, infección por H. pylori, tabaco y nitratos en la dieta. Inestabilidad de microsatélites (MSI)
Resultante de errores en la replicación del ADN, se observa en el 15-2% del cáncer gástrico con una mayor frecuencia en los casos familiares. Se ha sugerido que la alta frecuencia de MSI, asociada con cáncer gástrico de tipo intestinal invasivo y avanzado, se debe a la inactivación epigenética del gen de reparación de desajuste denominado hMLH1, mientras que las mutaciones en el factor de crecimiento transformante β (TGF-β) RII, el factor de crecimiento Ⅱ (IGFⅡ) R, y los genes BAX en tumores gástricos esporádicos con MSI muestran una tendencia disminuida de invasión y metástasis.
Oncogenes
La activación mutacional y/o la amplificación de varios oncogenes se ha documentado en el cáncer gástrico. Se encontró que el oncogén K-ras estaba mutado (codón 12) en el cáncer de tipo intestinal y sus lesiones precursoras, metaplasia intestinal y adenoma, pero no de tipo difuso. La sobreexpresión de cerbB2, un receptor de superficie celular de la familia de tirosina quinasa, es más común en cáncer gástrico de tipo intestinal; mientras que, en cáncer gástrico de tipo difuso, la amplificación de c-met, un receptor de tirosina quinasa transmembrana y aberraciones en el gen de la vía quinasa FGFR2 / ErbB3 / PI3, han sido documentados con frecuencia. Se observó una alta correlación entre EZH2 (el homólogo humano de la proteína Drosophila Enhancer of Zeste) con cáncer de tipo intestinal y el riesgo de metástasis a distancia.
Los genes supresores de tumores
Se han documentado alteraciones en una serie de TSGs (gen supresor de tumores, por sus siglas en ingles) en la patogénesis del cáncer de estómago. El gen p53 es frecuentemente inactivado en carcinomas gástricos, así como en lesiones precursoras por LOH, mutaciones “missense” o deleciones de “frameshift”. Las transiciones GC-AT del gen p53 son comunes en el cáncer gástrico de tipo difuso inducido por N-nitrosaminas, producidas a partir de aminas dietéticas y nitratos. LOH y mutaciones de PTEN en el cromosoma 10q23.31 se observaron en el cáncer gástrico, así como en las lesiones precancerosas y el gen RUNX3, un supresor de tumores que también participa en el complejo proceso de la oncogénesis gástrica (la hipermetilación del promotor RUNX3 en la gastritis crónica, la metaplasia intestinal y los adenomas gástricos sugiere que este gen es un blanco para el silenciamiento génico y epigenético en el cáncer de estómago).
Reguladores del ciclo celular, factores de crecimiento y citocinas
Las anormalidades genéticas y la expresión aberrante de los reguladores del ciclo celular juegan un papel fundamental en la patogénesis del cáncer gástrico. La sobreexpresión de ciclina E y CDK junto con la expresión p53 aberrante y la regulación negativa de p27 (sobreexpresión común en el cáncer gástrico), se asocia con mayor agresividad y mal pronóstico. Estudios de metaanálisis de polimorfismos genéticos relacionados con la proliferación celular reveló un riesgo significativamente mayor de cáncer de estómago de tipo difuso en individuos que albergan polimorfismos del gen TP53. La inmunohistoquímica y la tinción TUNEL (TdT-mediated dUTP-biotin nick end-labeling), realizada en portaobjetos de tejidos que contenían 293 muestras de carcinoma gástrico, mostraron una correlación positiva entre la expresión de ciclina D1, p21 o p27 con estadios tempranos de TNM, proliferación de células tumorales y un buen pronóstico, sin embargo, presenta una correlación inversa con la presencia de metástasis ganglionar. Además, la expresión de p27 se correlacionó inversamente con el índice de apoptosis, indicando que estos reguladores del ciclo celular pueden servir como marcadores moleculares candidatos para el carcinoma gástrico precoz. Los altos niveles de ARNm de la transcriptasa reversa de la telomerasa humana en células que se encuentran en circulación libre de pacientes con cáncer gástrico, sugieren que esta molécula puede ser útil como marcador no invasivo de diagnóstico y pronóstico. Varios factores de crecimiento y citoquinas producidas por el microambiente del tumor gástrico regulan la diferenciación, activación y supervivencia de múltiples tipos de células. Cambios extensos en los perfiles de expresión de los componentes de la vía de señalización de TGF-β y sus dianas se producen durante la progresión secuencial del epitelio normal a través de gastritis atrófica crónica y displasia a carcinoma. Estos cambios incluyen un aumento progresivo en la expresión de los genes TGFB1/2, TGFBR1, MYC y TP53, una expresión mejorada en displasia de los genes SMAD4, CDKN1A, SMAD1/2/3, SMAD2/3 y CDKN1B que se han visto disminuidos en carcinoma y con un aumento en la expresión de los genes TGFBR2, SMAD7, RELA; es importante mencionar que el gen CDC25A se encuentra expresado tanto en displasia como en carcinoma. Una revisión sistemática y metaanálisis de interleuquina (IL) -1B y polimorfismos de los genes en las posiciones 511, -31, y +3954, reveló que el alelo IL-1B -511 T e IL-1RN (intron 2 VNTR) se asocian significativamente con un mayor riesgo de desarrollar carcinoma gástrico.
Referencias
1. Nagini S. Carcinoma of the stomach: A review of epidemiology, pathogenesis, molecular genetics and chemoprevention. World J Gastrointest Oncol. 2012;15;4:156-69.
2. Figueiredo C, Garcia-Gonzalez MA, Machado JC. Molecular pathogenesis of gastric cancer. Helicobacter. 2013;18 Suppl 1:28-33.
3. Farrell P. Pathogenesis: Infections causing gastric cancer. Nat Microbiol. 2016;29;1:16038.
4. Valenzuela MA, Canales J, Corvalán AH, et al. Helicobacter pylori-induced inflammation and epigenetic changes during gastric carcinogenesis. World J Gastroenterol. 2015;7;21:12742-56.
5. Sohn BH, Hwang JE, Jang HJ. Clinical Significance of Four Molecular Subtypes of Gastric Cancer Identified by The Cancer Genome Atlas Project. Clin Cancer Res. 2017;26.
6. Ge S, Li B, Li Y, et al. Genomic alterations in advanced gastric cancer endoscopic biopsy samples using targeted next-generation sequencing. Am J Cancer Res. 2017;1;7:1540-1553.
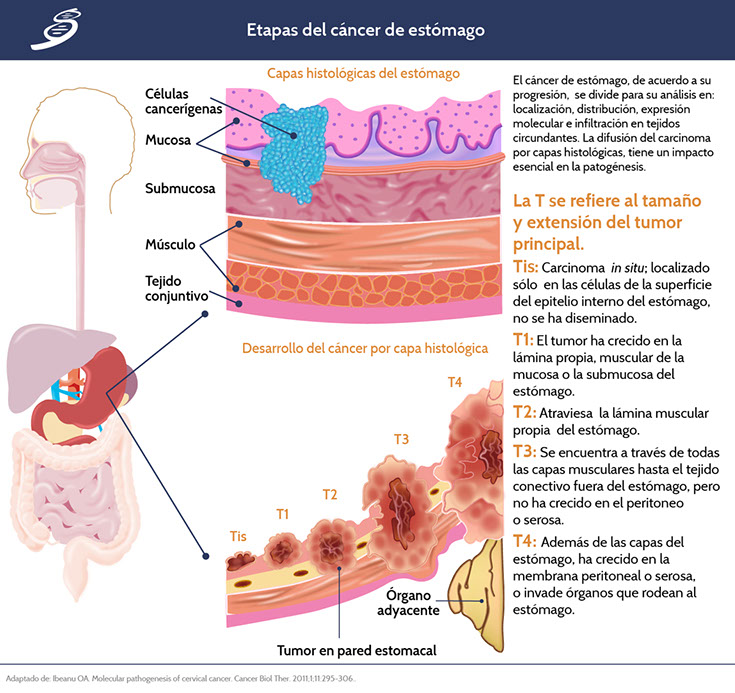
7. Instituto Nacional del Cáncer. Estadificación del cáncer. Diagnóstico y estadificación [Marzo 2015] Disponible en: https://www.cancer.gov/espanol/cancer/diagnostico-estadificacion/estadificacion [Revisado en Agosto 2017]
8. Rodriguez Simental RI. Estadios del cáncer de estómago. Oncología quirúrgica [Febrero 2014] Disponible en: http://oncologiadf.com/estadios-del-cancer-de-estomago/ [Revisado en Agosto 2017].
Periodismo científico cultural
Sobre el cigarro electrónico
Ya ha pasado tiempo desde que el cigarro se convirtió en el enemigo público número uno, tanto para fumadores como para no fumadores...
[leer mas]
la sal! Tu cerebro
y corazón lo agradecerán
La enfermedad diverticular y sus complicaciones son una causa importante de morbimortalidad en todo el mundo...
[leer mas]
El primer anticuerpo monoclonal para pacientes con hemofilia A e inhibidores a FVIII
Cuando se vive con hemofilia todo puede ser una amenaza para provocar sangrados; desde niños...
[leer mas]
Infografías
TODOS LOS DERECHOS RESERVADOS © SPG COMUNICACIONES SA DE CV 2012-2018
Diseño: A. Victoria Pérez
Aviso de privacidad




