Anticuerpo monoclonal diseñado selectivamente contra células B en la esclerosis múltiple
M en C. Itzel Rocio Manzano Espinosa
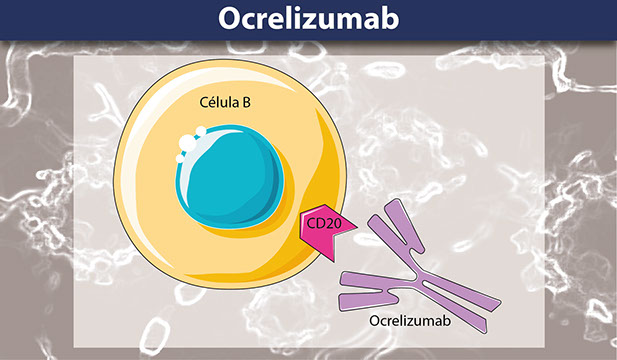
Ocrevus (ocrelizumab) es un anticuerpo monoclonal humanizado diseñado para seleccionar selectivamente células B positivas a CD20, un tipo específico de célula inmune que se cree es un contribuyente clave a la mielina y al daño de las células nerviosas axonales. Es la primera terapia aprobada por la Administración de Alimentos y Drogas (FDA por sus siglas en inglés) que trata tanto la esclerosis múltiple recurrente (EMR), como la esclerosis múltiple progresiva primaria (PPMS), una forma de enfermedad que previamente no tenía tratamientos aprobados. El blanco principal de este anticuerpo monoclonal son los linfocitos B, un tipo de célula inmunitaria, que expresan una proteína llamada CD20 en su superficie, característica que da al fármaco una función inmunosupresora.
Ocrevus es un anticuerpo monoclonal anti CD20 que se dirige a las células B maduras. Casi el 95% de las células B expresan la proteína CD20 en su superficie una vez que maduran y no las eliminan, lo que hace que CD20 sea un potente marcador con fines terapéuticos. Se cree que estos linfocitos B CD20 positivos dirigen los axones y las vainas de mielina de las neuronas sanas iniciando una serie en cascada de reacciones inmunitarias que conducen a la esclerosis múltiple y la discapacidad en los pacientes. Los estudios han demostrado que el ocrelizumab se une a células B específicas con marcadores CD20, pero no a células madre y células plasmáticas, preservando las funciones inmunitarias vitales dentro del huésped.
En los estudios fase III (OPERA I y OPERAII), OCREVUS demostró una eficacia superior en los tres marcadores principales de la actividad de la enfermedad reduciendo las recaídas, por año, casi a la mitad, ralentizando el empeoramiento de la discapacidad y reduciendo significativamente las lesiones por EMR.
En un estudio separado de fase III (ORATORIO), OCREVUS fue el primer y único tratamiento para reducir significativamente la progresión de la discapacidad y reducir los signos de actividad de la enfermedad en el cerebro (lesiones por EMR) en comparación con placebo en un seguimiento medio de tres años.
La Autorización de Comercialización de OCREVUS también ha sido validada por la Agencia Europea de Medicamentos (EMA) y en nuestro país por la Comisión Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS).
Referencias
1. Lau J, Bloch P, Schäffer L, Pettersson I, Spetzler J, Kofoed J, et al. The discovery of the once weekly glucagón like peptide 1 (GLP-1) analog semaglutide, J Med. Chem, 2015;
2. Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes, N Engl J Med, 2016;
3. Nauck MA, Petrie JR, Sesti G, Mannucci E, Courrèges JP, Lindegaard ML, et al. A Phase 2, Randomized, Dose-Finding Study of the Novel Once-Weekly Human GLP-1 Analog, Semaglutide, Compared With Placebo and Open-Label Liraglutide in PatientsWith Type 2 Diabetes, Diabetes Care, 2015; 1-11.
4. Scheen AJ. Semaglutide: a promising new glucagon-like peptide-1 receptor agonist, Lancet Diabetes Endocrinol, 2017; 1-2.
Periodismo científico cultural
Lo que no sabías
Sobre el cigarro electrónico
Ya ha pasado tiempo desde que el cigarro se convirtió en el enemigo público número uno, tanto para fumadores como para no fumadores...
[leer mas]
NO ABUSES DE LA SAL!
Tu cerebro y corazón lo agradecerán
Un alto consumo de sal puede tener un impacto dramático en la memoria y el funcionamiento cognitivo, independientemente de su efecto sobre la presión arterial, de acuerdo a un...
[leer mas]
El primer
anticuerpo monoclonal
para pacientes con hemofilia A e inhibidores a FVIII
[leer mas]
Ocrelizumab
podría retrasar siete años la necesidad de utilizar silla de ruedas en personas con esclerosis múltiple primaria progresiva
[leer mas]
Educación médica
Generalidades
Una hernia es una protrusión, protuberancia o proyección de un órgano o parte de
un órgano a través de...
[leer mas]
El primer reporte que se conoce sobre hernia de Richter fue realizado por Fabricius Hildanus en 1598...
[leer mas]
La hernia del obturador (HO) fue descrita por primera vez por el profesor francés ...
[leer mas]
Infografías
TODOS LOS DERECHOS RESERVADOS © SPG COMUNICACIONES SA DE CV 2012-2018
Diseño: A. Victoria Pérez
Aviso de privacidad