EDUCACIÓN MÉDICA
Enfermedades exantemáticasVaricelaRubeolaRoseolaParvovirus B19Sarampión
ENFERMEDADES EXANTEMÁTICAS DE LA INFANCIA
FISIOPATOLOGÍA
Sarampión
Actualmente, la infección por virus del sarampión (VS), en una época post-vacunas, es aún una causa de morbimortalidad en niños menores de 5 años. Según datos estadísticos del 2012, a nivel mundial hubo 122 000 muertes por sarampión, y en el intervalo del año 2000 a 2012, gracias a la vacunación, hubo una disminución del 78% de muertes que se tenían previamente. Actualmente, la Organización Mundial de la Salud tiene como objetivo reducir la tasa de mortalidad global en menores de 5 años por medio de campañas de vacunación.
Las manifestaciones clínicas (fiebre, rash, conjuntivitis) son consecuencia de la respuesta inmune del huésped en niños inmunocompetentes; dicha respuesta es exitosa tanto en eliminar la infección de los sitios de replicación, como en establecer inmunidad para toda la vida ante una reinfección.
Virus del sarampión
El VS es un virus ácido ribonucleico (ARN) de la familia Paramyxoviridae con envoltura de cadena negativa no segmentada que codifica 8 proteínas. La envoltura de hemaglutinina (H) y proteínas de fusión (pF) son proteínas transmembrana presentes en la superficie del virión que inicia la infección de células susceptibles. Contiene una nucleoproteína que forma una nucleocápside helicoidal alrededor del genoma de ARN para formar una ribonucleocápside. La fosfoproteína y la proteína polimerasa larga están asociadas con el ribonucleocápside, necesaria para la síntesis de ARN después del inicio de la infección. La matriz protéica se asocia con la superficie interior de envoltura lipídica que se une al complejo ribonucleoprotéico que envuelven las glucoproteínas durante el ensamblaje viral. Existen dos proteínas no estructurales (C y V) que están codificadas dentro del gen de la fosfoproteína a través de un sitio de traducción alternativo para edición de ARN. Las proteínas C y V no son necesarias para la replicación del VS, pero ambas asociadas a la fosfoproteína interactúan con las proteínas celulares y regulan la respuesta a la infección.
Las proteínas del VS H y pF se asocian en el retículo endoplásmico que, al momento de la unión de la H a un receptor, se desencadena la disociación de este complejo para fusionarse con la membrana celular. Por lo tanto, las células del huésped infectadas con VS expresan las proteínas virales H y pF en su superficie celular, así, la unión del receptor celular con la proteína H puede activar la función de fusión de pF de las células vecinas, que da como resultado la formación de sincitios o células gigantes, el efecto citopático típico del VS.
Inmunidad
La respuesta inmunológica contra el VS es tanto innata como específica. La H del VS es la responsable de la interacción con receptores del VS en células suceptibles, esto es un determinante importante del tropismo celular (especificidad de un virus para un tejido huésped particular). La H glucosilada está presente en la superficie de los viriones como un homotetrámero que consiste en un dímero de dos homodímeros unidos covalentemente. Se conocen tres receptores celulares para VS: CD46, como la proteína reguladora del complemento de relativamente baja afinidad presente en todas las células nucleadas; la molécula SLAM/CD150 de activación de señalización de linfocitos con más alta afinidad, presente en linfocitos, células del timo, macrófagos y células dendríticas; y un receptor no identificado presente en las células columnares ciliadas del epitelio respiratorio.
Respuesta innata
La interacción de la proteína H con el receptor tipo Toll 2 (TLR2) de la superficie de la célula monocítica, estimula la producción de interleucina-6 (IL-6) y aumenta la expresión de superficie de CD150; mientras, la intereacción con CD46 inhibe la producción de IL-12. La interacción de VS con células epiteliales induce la producción de IL-8, aumentando los niveles plasmáticos de ARN mensajero (mARN) para interleucina 1-beta (IL-1β) y factor de necrosis tumoral alfa (TNFα) por células mononucleares, incrementando estos niveles sanguíneos. La replicación del VS es necesaria para la inducción de la transcripción de interferón beta (IFN-β) en células sensibles.
Respuesta adaptativa
Se ha demostrado la infiltración de linfocitos T CD4+ y CD8+ en la erupción morbilifofrme; al principio, las células T CD4+ producen IFN-γ e IL-2, pero más tarde se producen IL-4, IL-10 e IL-13 durante varias semanas después de la eliminación del virus infeccioso y la resolución de la erupción, por lo que días después se establece la inmunidad de memoria. Después del periodo de depuración inicial de virus, existe activación de células T CD4+ Th2 y T reguladoras durante la recuperación.
Infección activa de sarampión
La infección se inicia de manera activa en el epitelio del tracto respiratorio, después de la inhalación de secreciones infectadas por VS, pero el tipo de célula que es altamente susceptible a la infección no está claro. Los neumocitos tipo I, macrófagos alveolares y las células epiteliales respiratorias son infectadas, pero no se ha determinado definitivamente si alguna de estas células es el sitio de la replicación inicial del virus.
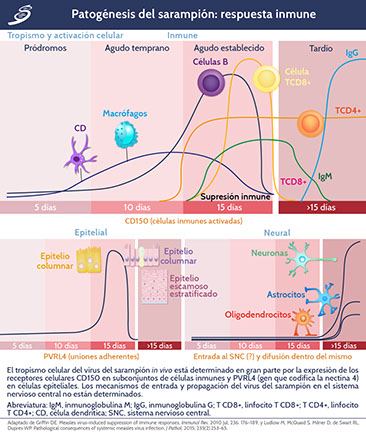
Es así como, desde el tracto respiratorio, el VS se disemina a tejidos linfoides adyacentes (ver imagen 1A) a través de las células dendríticas pulmonares o macrófagos alveolares, después existe una replicación en el tejido linfático que conduce a la diseminación sanguínea de células infectadas (células T, B, monocitos/macrófagos y células dendríticas) aproximadamente 7-9 días después de la infección. Vía hemática, la infección afecta el tejido linfoide distal, células epiteliales y endoteliales de múltiples órganos como hígado, cerebro y piel. Síntomas como fiebre, conjuntivitis y rash morbiliforme aparecen de 10 a 14 días después de la infección (ver imagen 2), coincidiendo con la respuesta inmune adaptativa y con la eliminación del virus, ésta se completa 20 días después de la infección, pero el ARN viral (representado por la línea punteada en el esquema de la imagen 1A) persiste en múltiples sitios (ver esquema en imagen 2), al momento de la erupción, tanto el anticuerpo específico como las células T activadas se detectan en el plasma (ver imagen 3). La erupción maculo-papular es secundario a la infiltración de linfocitos T CD4+ y T CD8+ en los sitios de replicación del virus. En este momento hay una activación y expansión rápida de células T CD8+, para que después se encuentren células T CD8+ específicas para el VS. La respuesta de los linfocitos T CD4+ también está presente, pero la activación es prolongada; al momento de la erupción está presente en plasma la inmunoglobulina M (IgM) específica que sirve como método diagnóstico, posteriormente, de manera sostenida se secreta IgG para VS.


Una de las características principales de la infección por VS es la inmunosupresión, la cual es evidente durante la enfermedad aguda y por muchas semanas después de la recuperación. Durante la infección se secretan citocinas y quimiocinas como IL-8, así como IFN-γ e IL-2 producidas por las células T CD4+ tipo 1 (Th1) y T CD8+ activadas (ver imagen 3); después de la resolución del rash, las células T CD4+ th2 y T reguladoras producen IL-4, IL-10 e IL-13.
Complicaciones
Si existe antecedente de inmunodeficiencia, puede causar una neumonía progresiva o encefalitis fatal. El VS también infecta células endoteliales en muchos órganos e infecta neuronas y astrocitos como parte de la infección persistente del sistema nervioso asociada con panencefalitis esclerosante subaguda.
Bibliografía
Chen SSP. Measles, Pediatrics: General Medicine, [Updated: Nov 28, 2017] disponible en:
https://emedicine.medscape.com/article/966220-overview#a4 [revisado diciembre 2017]
Griffin DE. Measles virus-induced suppression of immune responses, Immunol Rev. 2010 Jul; 236: 176–189.
Avota E, Gassert E, Schneider-Schaulies S. Measles virus-induced immunosuppression: from effectors to mechanisms, Medical Microbiology and Immunology, 2010; Volume 199, Issue 3, pp 227–237
Gardy JL, Naus M, Amlani A, Chung W, Kim H, Tan M, et al. Whole-Genome Sequencing of Measles Virus Genotypes H1 and D8 During Outbreaks of Infection Following the 2010 Olympic Winter Games Reveals Viral Transmission Routes, J Infect Dis, 2015; 212(10):1574-8.
Lina WHW, Pana CH, Adams RJ, Laubec BL, Griffina DE, et al. Vaccine-Induced Measles Virus-Specific T Cells Do Not Prevent Infection or Disease but Facilitate Subsequent Clearance of Viral RNA, mBio, 5(2): e01047-14.
Ludlow M, McQuaid S, Milner D, de Swart RL, Duprex WP. Pathological consequences of systemic measles virus infection, J Pathol, 2015; 235(2):253-65.
Pfaller CK, Radeke MJ, Cattaneo R, Samuel CE. Measles virus C protein impairs production of defective copyback double-stranded viral RNA and activation of protein kinase R, J Virol, 2014; 88(1):456-68.
Fiebelkorn AP, Coleman LA, Belongia EA, Freeman SK, York D, Bi D, et al. Measles Virus Neutralizing Antibody Response, Cell-Mediated Immunity, and Immunoglobulin G Antibody Avidity Before and After Receipt of a Third Dose of Measles, Mumps, and Rubella Vaccine in Young Adults, J Infect Dis, 2016; 213(7):1115-23.
Aviso de privacidad
Diseño: A. Victoria Pérez
