EDUCACIÓN MÉDICA
ENFERMEDAD PULMONAR OBSTRUCTIVA CRÓNICA
FISIOPATOLOGÍA
La enfermedad pulmonar obstructiva crónica (EPOC) es una patología inflamatotria del pulmón, especialmente localizada en vías respiratorias periféricas y el parénquima pulmonar, que aumenta durante las exacerbaciones agudas. También se asocia con inflamación sistémica, que puede contribuir al empeoraramiento de varias comorbilidades. Los principales cambios fisiopatológicos son: la remodelación y el estrechamiento de las vías respiratorias pequeñas, y destrucción del parénquima pulmonar con la subsecuente destrucción de las uniones alveolares. El Diagrama de Venn de la siguiente figura de EPOC, muestra cómo es una patología crónica en la cual, subconjuntos de pacientes pueden tener características dominantes de bronquitis crónica, enfisema o asma.

Mecanismos inflamatorios de la vía aérea
La inflamación en EPOC involucra respuestas inmunitarias innatas y adaptativas, a través de la activación celular. Aunque la base molecular para la amplificación de la inflamación no se conoce del todo, se entiende que está en parte determinada por factores genéticos y epigenéticos.
El humo de cigarro y otros irritantes inhalados como la exposición crónica a biomasa (humo de combustibles tales como leña), son los activadores de la respuesta innata en la superficie celular del tracto respiratorio, los macrófagos de la superficie de las células epiteliales atraen neutrófilos, monocitos y linfocitos circulantes por medio de quimiotaxis hacia los pulmones. La respuesta inflamatoria persiste incluso en fumadores inactivos, lo que sugiere que existen mecanismos auto-perpetuantes, aunque aún se desconocen; podría ser posible que células T de memoria, colonización bacteriana o autoinmunidad conduzcan a la inflamación persistente de pacientes con EPOC.
Inflamación celular
• Células epiteliales
Después de la activación celular por inhalantes, se producen mediadores inflamatorios como factor de necrosis tumoral alfa (TNF-α), interleucina (IL) 1 beta (IL-1β), IL-6, factor estimulante de colonias de granulocitos y macrófagos (GM-CSF) e IL-8 (también llamada CXCL8). Las células epiteliales de las vías respiratorias pequeñas expresan factor de crecimiento transformador-beta (TGF-β) que posteriormente induce fibrosis local. El factor de crecimiento endotelial vascular (VEGF) es necesario para mantener la integridad de las células de los alveolos, dicho factor está reducido en fumadores y pacientes con EPOC, así como también el factor de crecimiento de hepatocitos.
Las células epiteliales también son fundamentales para la defensa de las vías respiratorias, con producción de moco por las células caliciformes y secreción de antioxidantes, antiproteasas y defensinas/catelicidinas. En EPOC hay un aumento en la expresión de factores de crecimiento epitelial (EGFR) en las células epiteliales, aumentando la proliferación de células basales, pudiendo resultar en metaplasia escamosa y mayor riesgo de carcinoma bronquial. Los EGFR’s también tienen un papel en la hiperplasia y secreción de moco, activados por la inflamación neutrofílica a través de la secreción de elastasa de neutrófilos, que libera TNF-α; también el estrés oxidativo puede activar EGFR’s e inducir hipersecreción mucosa.
• Macrófagos
En pacientes con EPOC, los macrófagos están incrementados de 5 a 10 veces en la vía aérea; se localizan en sitios destruidos de la pared alveolar en enfisema, habiendo una correlación entre el número de macrófagos en el parénquima pulmonar y la severidad del enfisema. Los macrófagos se activan por humo de cigarro (más común), liberando mediadores inflamatorios como TNF-α, IL-1, IL-8, CCL2 (proteína quimiotáctica de monocitos 2), leucotrienos B4 (LT B4) y especies reactivas de oxígeno (ROS). También, secretan enzimas elastolíticas como metaloproteinasas de la matriz (MMP) 2, 9 y 12; así como catepsinas K, L y S. La enzima elastolítica secretada por los macrófagos alveolares que predomina es la MMP-9.
La mayoría de las proteínas inflamatorias, están reguladas por el factor de transcripción nuclear kappa beta (NF-kβ) (esquematizado en la siguiente imagen), por medio de retroalimentación positiva en los macrófagos alveolares, especialmente en exacerbaciones. De manera progresiva (más en fumadores) aumenta el número de macrófagos pulmonares por aumento en el reclutamiento de monocitos de la circulación en respuesta a quimiocinas selectivas de monocitos IL-2, IL-1.

Tanto en macrófagos alveolares como en monocitos, existe una reducción en la fagocitosis de bacterias, lo cual determina una colonización crónica de vías aéreas inferiores de bacterias (al menos en un 50% de los pacientes) como Haemophilus influenzae o Streptococcus pneumoniae; además, su función de fagocitar células apoptóticas se torna defectuosa, contribuyendo a la falla en la resolución de la inflamación.
• Neutrófilos
Uno de los estímulos para el aumento en la producción y liberación de granulocitos de la médula ósea, es ser fumador activo, posiblemente mediado por GM-CSF y los macrófagos pulmonares. Además, existe reclutamiento de neutrófilos hacia el parénquima pulmonar por medio de adhesión a células endoteliales a través de E-selectina; los neutrófilos migran atraídos por quimiotaxis de células T, células epiteliales y de los mismos neutrófilos por sustancias como LTB4, IL-1, IL-5 e IL-8.
Los neutrófilos, ya en vías aéreas, son activados por proteínas incrementadas como mieloperoxidasa y lipocaína neutrófila humana para secretar serinas proteasas como elastasa neutrófila, catepsina G, proteinasa-3, MMP-8 y MMP-9, que contribuyen a la destrucción alveolar. La neutrofilia está relacionada con la hipersecreción de mucosidad debido a que sus proteasas son potentes estimulantes de la secreción mucosa de las glándulas submucosas y las células caliciformes.
• Eosinófilos
Se sabe que los eosinófilos predominan en pacientes con asma, pero en EPOC no es igual, se ha descrito su aumento en EPOC estable, ya que se relaciona a mejor respuesta al tratamiento broncodilatador.
• Linfocitos
Los linfocitos aumentan en el parénquima pulmonar y vías respiratorias periféricas y centrales de pacientes con EPOC, con mayor aumento en linfocitos T-CD8+ que T-CD4+ (Th1). Hay una correlación entre el número de células T, la cantidad de destrucción alveolar y la gravedad de la obstrucción del flujo aéreo.
Dentro de los linfocitos T-CD4+, están los Th17 que secretan IL-17 A e IL-22, éstas también están aumentadas en EPOC magnificando la actividad de los neutrófilos; estos linfocitos Th17 pueden ser regulados por la IL-6 e IL-23, liberadas por los macrófagos alveolares. Tanto los linfocitos T CD4+ y CD8+ expresan un aumento del receptor de quimiocinas CXCR3, el cual es activado por las quimiocinas CXCL9, CXCL11 y CXCL 10, ésta última sobre expresada por células epiteliales bronquiales, contribuyendo también a la acumulación de linfocitos T CD4+ y CD8+.

Otro de los mecanismos causantes de daño son los anticuerpos antiendoteliales, cuyos niveles están aumentados en el EPOC, tienen un mecanismo de daño a través de la unión al complemento. También se han encontrado proteínas citrulinadas con la capacidad de inducir la formación de autoanticuerpos.
Las células epiteliales alveolares son dañadas también por linfocitos T-CD8+ por medio de citólisis por liberación de perforinas, granzima B y TNF-α, resultando finalmente en apoptosis, además, los linfocitos T CD8+ han mostrado evidencia de presentar senescencia inmunológica en pacientes con EPOC.
El número de linfocitos B también se encuentra incrementado, particularmente en enfermedad grave; los linfocitos B se organizan en folículos linfoides y parénquima pulmonar. El factor activador de células B es un importante regulador de la función de las mismas y de su hiperplasia, su expresión está aumentada en los folículos linfoides de pacientes con EPOC.
• Células dendríticas
Las células dendríticas son un vínculo importante entre la inmunidad innata y adaptativa; están localizadas cerca de la superficie de la vía aérea, de modo que están idealmente ubicadas para indicar la entrada de sustancias extrañas inhaladas. Las células pueden activar otras células inflamatorias e inmunitarias, incluidos macrófagos, neutrófilos y linfocitos T y B, y, por lo tanto, las células dendríticas desempeñan un papel importante en la respuesta pulmonar al humo del cigarrillo y otros agentes nocivos inhalados.
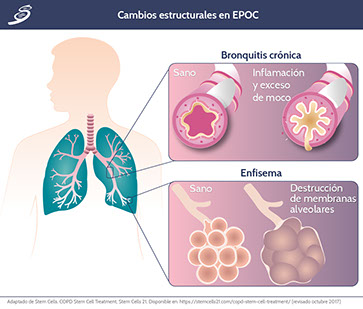
Cambios estructurales
La remodelación de la pared de la vía aérea en pacientes con EPOC implica: reparación de tejidos y la metaplasia epitelial, aumento de metaplasia en mucosa e hipertrofia de las glándulas submucosas, fibrosis peribronquial y aumento de la masa del músculo liso de la vía aérea. Además de sus propiedades contráctiles, las células bronquiales producen mediadores inflamatorios que también interactúan con los mecanismos inmunitarios de la inflamación, causando remodelación de la pared de la vía aérea en pacientes con EPOC. Los principales factores que contribuyen a la remodelación estructural son: fibrosis peribronquial, acumulación de tejido cicatrizal por el daño inflamatorio y la sobre-multiplicación de células epiteliales.
Bibliografía
Mosenifa Z. Chronic Obstructive Pulmonary Disease (COPD), Medscape, [Updated: Sep 25, 2017] Disponible en: https://emedicine.medscape.com/article/297664-overview#a2 [revisado octubre 2017]
Barnes PJ. Cellular and molecular mechanisms of chronic obstructive pulmonary disease, Clin Chest Med. 2014; 35(1):71-86.
Barnes PJ. Inflammatory mechanisms in patients with chronic obstructive pulmonary disease, J Allergy Clin Immunol, 2016; 138(1):16-27.
Barnes PJ. Cellular and molecular mechanisms of chronic obstructive pulmonary disease, Clin Chest Med, 2014; 35(1):71-86.
Marin L, Colombo P, Bebawy M, Young PM, Traini D. Chronic obstructive pulmonary disease: patho-physiology, current methods of treatment and the potential for simvastatin in disease management, Expert Opin Drug Deliv. 2011; 8(9):1205-20.
Wiegman CH, Michaeloudes C, Haji G, Narang P, Clarke CJ, Russell KE. Oxidative stress-induced mitochondrial dysfunction drives inflammation and airway smooth muscle remodeling in patients with chronic obstructive pulmonary disease, J Allergy Clin Immunol, 2015; 136(3):769-80.
Think COPDifferently. Pathophysiology of COPD, Think COPDifferently, Disponible en: http://www.thinkcopdifferently.com/en/About-COPD/What-is-COPD/Pathophysiology-of-COPD [revisado octubre 2017]
Mosenifa Z. Chronic Obstructive Pulmonary Disease (COPD), Medscape, [Updated: Sep 25, 2017] Disponible en: https://emedicine.medscape.com/article/297664-overview#a3 [revisado octubre 2017]
Stem Cells. COPD Stem Cell Treatment, Stem Cells 21, Disponible en: https://stemcells21.com/copd-stem-cell-treatment/ [revisado octubre 2017]
Aviso de privacidad
Diseño: A. Victoria Pérez
