EDUCACIÓN MÉDICA
ENFERMEDAD DIVERTICULAR
La enfermedad diverticular y sus complicaciones son una causa importante de morbimortalidad en todo el mundo y una carga para los sistemas de salud; es especialmente común en el mundo occidental. Es muy importante entender y diferenciar las definiciones de cada término a utilizar para que no se preste a la confusión. Los mismos se clasifican en la siguiente Tabla:

Anatómicamente, un divertículo es la protrusión de la mucosa en forma de saco a través de la pared muscular del colon, dicha protrusión ocurre en áreas débiles de la pared intestinal en las que penetran los vasos sanguíneos; típicamente miden de 5-10mm de tamaño. Por definición, los divertículos son realmente “pseudodivertículos” (divertículos falsos), ya que contienen sólo mucosa y submucosa cubiertos por serosa.
La inflamación de uno o varios divertículos, conduce a la diverticulitis y puede ser un proceso tanto crónico como agudo. La diverticulitis es la complicación más común de la diverticulosis, en un porcentaje de 10% a 25% de los pacientes. La fisiopatología de la diverticulitis es la obstrucción del saco diverticular por un fecalito que, por irritación de la mucosa, causa inflamación de bajo grado, congestión y obstrucción adicional.
La hemorragia diverticular es la causa más común de hemorragia digestiva baja y los factores de riesgo incluyen obesidad, hipertensión, uso de anticoagulantes, diabetes mellitus y cardiopatía isquémica.
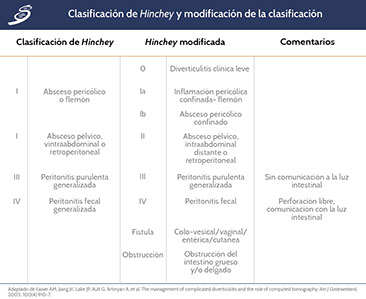
Esquema de clasificación de Hinchey
La clasificación de gravedad de la diverticulitis a menudo se clasifica con el uso de los Criterios de Hinchey (esquematizados en la siguiente imagen), aunque este sistema de clasificación no tiene en cuenta los efectos de las enfermedades coexistentes sobre la gravedad de la enfermedad o el resultado. El riesgo de muerte es inferior al 5% para la mayoría de los pacientes con diverticulitis en estadio 1 ó 2; aproximadamente 13% para aquellos con estadio 3, y 43% para aquellos con estadio 4.

Se debe de tener en cuenta que la clasificación de Hinchey se ha usado para distinguir cuatro estadios de diverticulitis aguda basado en hallazgos clínicos. Con el uso de la Tomografía Computarizada, que es la herramienta más sensible de elección en estos casos; se han establecido varias modificaciones para subcategorías que toman en cuenta los hallazgos radiológicos como se describe a continuación en la Tabla.
Factores de riesgo
Todas las investigaciones sobre factores de riesgo reconocen que el más fuerte para el desarrollo de diverticulosis es el , aumentando constantemente con la edad, alcanzando alrededor del 30% a los 65 años y el 50% en los mayores de 75 años. Por lo tanto, se debe considerar una enfermedad degenerativa en la que la debilidad del tejido conectivo de soporte y la alta presión característica de la luz del colon sigmoide, conducen a la formación de divertículos.
Los factores de riesgo primarios son los siguientes:
• Dieta baja en fibra
• Alta ingesta de carnes rojas y grasa
• Cafeína, alcohol y cigarro (No se ha demostrado que el consumo de cafeína y alcohol tenga mayores tasas de complicaciones diverticulares)
• Estilo de vida sedentario (falta de ejercicio y obesidad)
• Medicamentos: antiinflamatorios no esteroideos (AINE)s, opioides, esteroides, estatinas y vitamina D
La hemorragia diverticular es la causa más común de hemorragia digestiva baja; se observó que las probabilidades de perforación y formación de abscesos aumentaron con el uso de AINEs, esteroides y opiáceos en 2.49, 9.08 y 2.52, respectivamente. Las probabilidades de hemorragia diverticular por AINE, aspirina y bloqueantes de los canales de calcio también aumentaron a 2.69, 3.24 y 2.5, respectivamente. Además de lo anterior, el consumo de alcohol, el índice de tabaquismo, la aspirina en dosis baja y los antiagregantes plaquetarios sin aspirina se identificaron como factores independientes. Además, la terapia dual conlleva un mayor riesgo que la monoterapia.
Varios estudios de cohortes a largo plazo han demostrado una asociación entre el bajo consumo de fibra y el mayor riesgo de desarrollar enfermedad diverticular sintomática. El Estudio de Seguimiento de Profesionales de la Salud estudió prospectivamente a 47 228 profesionales de la salud de EE. UU. de entre 40 y 75 años. Un análisis después de cuatro años de seguimiento mostró un efecto protector de la fibra de frutas y vegetales; los que estadísticamente quedaron en el quintil superior, tienen un riesgo relativo de desarrollar enfermedad diverticular sintomática de 0.6 y 0.59, respectivamente, en comparación con aquellos en el quintil más bajo. Este estudio también mostró que el mayor factor de riesgo individual fue la alta ingesta de carne roja. El aumento de la ingesta de proteína animal es una de las diferencias más notables entre las naciones subdesarrolladas e industrializadas junto con la disminución de la fibra dietética.
La obesidad, que ha ido en constante aumento en Japón y en la mayor parte del sudeste asiático, ha sido reconocida como un importante factor de riesgo para el desarrollo de enfermedad diverticular sintomática. El aumento de la deposición de grasa en el mesenterio parece conducir a la activación de macrófagos dentro del tejido adiposo, lo que sugiere que la acumulación de grasa per se podría ser proinflamatoria. Sin embargo, la translocación de bacterias luminales también puede desempeñar un papel, ya que los estudios recientes en animales indican que la grasa mesentérica es una parte importante de la defensa del cuerpo contra la translocación bacteriana del intestino a la circulación sistémica.
En cuanto a las características heredo-familiares, en un estudio de Strate, et al., realizado en gemelos y hermanos, observaron un riesgo relativo de 2.92 para enfermedad diverticular en hermanos, en comparación con la población general. Los gemelos monocigóticos tenían una razón de probabilidad más alta de 14.5, en comparación con los gemelos dicigóticos de 5.5. Se estimó que la contribución hereditaria a la enfermedad diverticular fue del 53%.
Factores de riesgo de recurrencia de la enfermedad diverticular
En un estudio reciente de DiSiena y Birk, mencionan sobre los factores de riesgo que, análogamente a las sobreestimaciones previas del riesgo de un ataque inicial de diverticulitis, también se han exagerado las estimaciones de riesgo de tener un ataque recurrente de diverticulitis. Las primeras estimaciones de recidiva de la enfermedad oscilaron entre ~ 25% y 45%; incluso, en los años 1990, se afirmaba que >60% de los tratamientos médicos para un ataque de diverticulitis tenían síntomas persistentes y, debido a estas altas estimaciones de recurrencia, se asumió que los episodios recurrentes fueron más complicados y tuvieron una mayor morbilidad y mortalidad. Múltiples estudios más recientes han informado tasas de recurrencia más bajas (13.3% -23.4%) además de que <6% de estos pacientes, con enfermedad complicada, necesitaron cirugía de emergencia.
Algunos han postulado que puede haber diferentes factores de riesgo exclusivamente para la recurrencia de la enfermedad. Un estudio retrospectivo de casi 1 000 pacientes, que evaluó los pronosticadores clínicos y de tomografía computarizada de enfermedad recurrente, encontró que los antecedentes familiares de diverticulitis, > 5 cm de colon involucrado y un absceso retroperitoneal, se asociaron con diverticulitis recurrente. Sin embargo, ni la edad, el sexo, tabaquismo ni los medicamentos demostraron ser factores de riesgo de recidiva.
FISIOPATOLOGÍA
Motilidad colónica
La degeneración nerviosa ligada a la edad también puede contribuir a la disfunción de la motilidad, existe evidencia que sugiere la reducción de las neuronas en el plexo mientérico, la disminución de las células gliales mientéricas y las células intersticiales de Cajal de forma relacionada con la edad. También se ha descrito hipersensibilidad a la denervación, situación de los nervios entéricos que puede conducir a contracciones descoordinadas y alta presión, produciendo diverticulosis. La hipertrofia muscular asociada y los nervios entéricos alterados pueden ser el resultado de la remodelación después de la inflamación aguda; numerosos estudios han demostrado estar asociados con hipertrofia muscular, motilidad anormal, hipersensibilidad visceral y alteración de la codificación neuroquímica. Tales cambios pueden explicar la experiencia común del desarrollo de dolor abdominal recurrente y hábito intestinal alterado después de un episodio de diverticulitis aguda.
Alteraciones de la microbiota
Se han encontrado variaciones específicas de la enfermedad en la composición del microbioma intestinal para una serie de trastornos intestinales. Utilizando una técnica de perfilado, basada en la reacción en cadena de la polimerasa en aislados de ADN de muestras fecales, Daniels et al. recientemente comparó la microbiota fecal de pacientes con diverticulitis con sujetos de control de una práctica gastroenterológica general. Hallaron que las proporciones de Firmicutes/Bacteroidetes y la carga de Proteobacterias fueron comparables entre pacientes y controles (P = 0.20), mientras que encontraron una mayor diversidad en diverticulitis para Proteobacteria (P <0.00002) y todos los phyla combinados (P = 0.002).
La microbiota dentro de las capas mucosas y suprayacentes de las mucosas tiene una relación íntima con las células del huésped, influenciando la función de barrera y la interacción con el sistema inmune, ya sea directamente o mediante la producción de metabolitos y proteínas secretadas. Bacteroides fragilis, un anaerobio comúnmente aislado de abscesos intraabdominales, secreta un polisacárido conocido por inducir células T reguladoras. Los metabolitos bacterianos importantes incluyen los ácidos grasos de cadena corta (AGCC) derivados de la fermentación anaeróbica de carbohidratos no absorbidos. Los Clostridiales son los principales productores del AGCC butirato, que desempeña un papel significativo en el bienestar metabólico de los colonocitos. El butirato influye en la motilidad y los nervios entéricos, al mismo tiempo que ejerce efectos antiinflamatorios al inhibir el factor nuclear kappa-beta (NF-κβ). Las bacterias del grupo IV de Clostridium también son inductores potentes de las células T reguladoras en el colon, por lo que su agotamiento podría dar lugar a una mayor activación inmune de la mucosa. Alternativamente, podría ser que la inflamación de bajo grado crea un ambiente desfavorable para estos anaerobios obligados. Akkermansia muciniphila depende de la mucosa secretada por el huésped para la supervivencia y, a su vez, parece estimular la producción de endocannabinoides intestinales que promueven la integridad de la barrera epitelial y suprimen la inflamación. La depleción de la mucosa en la enfermedad diverticular, como se ve en la colitis ulcerativa, puede ser una posible explicación de la reducción observada de Akkermansia de la región diverticular de pacientes con enfermedad diverticular sintomática no complicada y la correlación negativa con la cuenta de macrófagos.
Cambios en la pared del colon
El engrosamiento crónico de la pared del colon, con contracción de la musculatura, explica los síntomas clínicos de dolor y alteración del hábito intestinal. Por endoscopia, el orificio de un divertículo es de un corte claro y a menudo va acompañado de crestas circulares indicativas de hipertrofia de la capa muscular. Un orificio puede ocluirse por un fecalito con la inflamación resultante, conduciendo a una perforación contenida o abierta. En la diverticulitis aguda, hay evidencia de inflamación aguda alrededor de un divertículo; con frecuencia sólo uno está involucrado y, usualmente, está asociado con una reacción peritoneal. Puede haber adhesión a una estructura vecina, como la vejiga en los hombres o el útero o la vagina en las mujeres. La perforación local, si está contenida, causará la formación de abscesos en la región paracólica inmediata o en la pelvis, si el asa sigmoidea está ubicada en la bolsa de Douglas. Alternativamente, un absceso puede erosionarse en una estructura vecina y causar una fístula. Una perforación, o perforación libre de un absceso paracólico ya formado, dará lugar a una peritonitis-fecal generalizada en la circunstancia anterior y purulenta en la segunda. La gravedad de las complicaciones sépticas es de acuerdo a la clasificación de Hinchey. La imagen bacteriana es compleja y no existen datos significativos sobre la causalidad a este respecto. En un estudio de 110 especímenes de la cavidad peritoneal, después de la perforación y de 22 abscesos intraabdominales, Brook y Frazier aislaron muchas especies bacterianas. No es sorprendente que la mayoría incluyera Escherichia coli, Streptococcus spp., Bacteroides, Peptostreptococcus, Clostridium y Fusobacterium.
Inflamación subclínica y su papel en enfermedad diverticular
En los últimos años, varios hallazgos han respaldado un papel significativo de la inflamación en la determinación de la aparición de síntomas y complicaciones en esos pacientes:
1. La enfermedad diverticular presenta un infiltrado inflamatorio microscópico significativo; va desde el aumento de la infiltración linfocítica crónica, hasta el infiltrado neutrofílico activo, lo cual parece estar relacionado con la gravedad de la enfermedad.
2. La enfermedad diverticular muestra una sobreexpresión de citocinas proinflamatorias como factor de necrosis tumoral alfa (TNF-α). Además, esta sobreexpresión disminuye paralelamente con la respuesta al tratamiento.
3. La obesidad es un factor de riesgo para la recurrencia de diverticulitis, debido al efecto proinflamatorio de las adipocinas y quimiocinas.
4. Tanto la inflamación endoscópica como la histológica persistente se han identificado recientemente como factores de riesgo significativos para la recurrencia de la diverticulitis.
5. Hasta el 20% de los pacientes se quejan de dolor abdominal persistente después del tratamiento quirúrgico, además de que existe una disminución en la calidad de vida después de la cirugía. Se ha formulado la hipótesis de que los síntomas persistentes están relacionados con el aumento de los neuropéptidos en las biopsias de la mucosa, que pueden reflejar una inflamación aguda anterior resuelta y una inflamación crónica persistente.
Referencias
Shahedi K. Diverticulitis, Gastroenterology, [Updated: Aug 15, 2017] disponible en:
https://emedicine.medscape.com/article/173388-overview#a6 [revisado marzo 2018]
Tursi A, Papa A, Danese S. Review article: the pathophysiology and medical management of diverticulosis and diverticular disease of the colon, Aliment Pharmacol Ther, 2015; 42(6):664-84.
Jacobs DO. Diverticulitis, N Engl J Med, 2007;357:2057-66.
Kaiser AM, Jiang JK, Lake JP, Ault G, Artinyan A, et al. The management of complicated diverticulitis and the role of computed tomography, Am J Gastroenterol, 2005; 100(4):910-7.
Strate LL, Erichsen R, Baron JA, Mortensen J, Pedersen JK, Riis AH, et al. Heritability and familial aggregation of diverticular disease: a population-based study of twins and siblings, Gastroenterology. 2013 Apr;144(4):736-742.e1; quiz e14.
Mosadeghi S, Bhuket T, Stollman N. Diverticular disease: evolving concepts in classification, presentation, and management, Curr Opin Gastroenterol, 2015; 31(1):50-5.
Spiller RC. Changing views on diverticular disease: impact of aging, obesity, diet, and microbiota, Neurogastroenterol Motil, 2015; 27(3):305-12.
Nicholls RJ. Diverticular Disease, Abdominal Key Fastest Abdominal Insight Engine, [Jul 17, 2016] disponible en: https://abdominalkey.com/diverticular-disease-2/ [revisado abril 2018]
Spiller RC, Sloan TJ. Do diverticula provide a unique niche for microbiota which can lead to activation of the innate immune system? Gut, 2017; 66(7):1175-1176.
Hall JF, Roberts PL, Ricciardi R, et al. Long-term follow-up after an initial episode of diverticulitis: what are the predictors of recurrence? Dis Colon Rectum 2011;54:283–288.
DiSiena MSy Birk JW. Diverticular Disease: The Old, the New, and the Ever-Changing View, DISCLOSURES South Med J, 2018;111(3):144-150.
Rezapour M, Ali S, Stollman N. Diverticular Disease: An Update on Pathogenesis and Management, Gut Liver, 2018; 12(2):125-132.
Aviso de privacidad
Diseño: A. Victoria Pérez
