EDUCACIÓN MÉDICA
Diarrea inflamatoriaEntamoeba HistolyticaCampylobacter jejuniClostridium DifficileSalmonellaShingellaVibrio ParahaemolyticusCitomegalovirus
ENFERMEDAD DIARRÉICA PARASITARIA
FISIOPATOLOGÍA DE TIPO INFLAMATORIA
Amebiasis
La amebiasis es básicamente una enfermedad aguda adquirida por: (I) la ingestión de quistes presentes en alimentos, agua o plantas contaminados, (II) por contacto de persona a persona (fecal), (III) exposición en áreas endémicas y (IV) nadar en aguas contaminadas. Las manifestaciones clínicas varían desde el estado de portador asintomático a los síntomas disentéricos representados por dolor abdominal y diarrea sanguinolenta.
Los parásitos se encuentran tanto en regiones frías, como en tropicales y subtropicales, su denominador común es el agua contaminada. Inadecuadas instalaciones de alcantarillado y trata de agua de los servicios de saneamiento; es una importante causa de morbimortalidad en países subdesarrollados y en desarrollo, posiblemente también por una resistencia adquirida de los parásitos a los desinfectantes y al pequeño tamaño de los quistes.
Entamoeba histolytica (E. hystolitica) es el principal agente causal de la amebiasis, es un parásito protozoario responsable de casi 100 000 muertes en todo el mundo. Después de Plasmodium spp., se estima que E. histolytica es la segunda causa principal de muerte debido a un parásito protozoario; en su mayoría son consecuencia de complicaciones graves asociadas con la enfermedad invasiva intestinal o extraintestinal.
Aunque todas las muertes podrían deberse a una infección invasiva por E. histolytica, los datos sobre su prevalencia podrían ser una sobreestimación ya que los datos provienen de una fecha en el tiempo anterior a la separación de E. histolytica patógena de la especie no patógena. E. dispar y E. moshkovskii, mismas que pueden contribuir a las cifras de prevalencia.
Modo de contaminación por amebiasis
Los portadores sanos del parásito o los enfermos son la única fuente de contaminación. La transmisión se realiza vía fecal-oral, ya sea directamente por contacto de persona a persona (manos sucias) o indirectamente a través de alimentos o agua contaminada con heces que contienen quistes de ameba.
Susceptibilidad de la población
En la población infantil se registró una prevalencia global importante en todo el mundo. En India, Kaur et al. (2002) informaron del 11% de las infecciones por E. histolytica, mientras que el equipo de Ali et al. (2003) encontraron casi la misma tasa (15.6%) en niños preescolares en Bangladesh. Se notificaron tasas más altas de 65.7% en niños nigerianos menores de cinco años (Ogunlesi et al., 2006). Asimismo, Hegazi, et al. (2013) y su grupo informaron una tasa de infección importante de amebiasis en niños menores de un año y atribuyeron esta alta prevalencia a la lactancia inadecuada. Estos resultados son de gran preocupación para la salud pública considerando los impactos de la enfermedad. Los niños infectados con amebiasis mostraron una pérdida de peso significativa en comparación con aquellos, de la misma edad, que no estaban infectados (Haque et al., 2006). También se supone que la infección se adquiere directamente de la madre infectada a los recién nacidos. En México, la infección en mujeres embarazadas se ha estimado entre 22.5% y 35% con 15% de sus hijos infectados intestinalmente.
Entamoeba histolytica
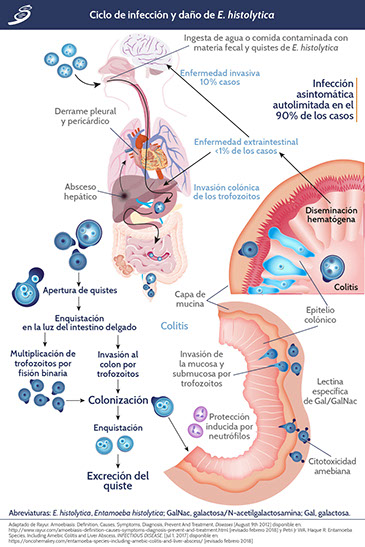
E. histolytica es monogenética o monoxénica, lo que significa que su ciclo de vida se completa sólo en un huésped, que generalmente es humano, y no necesita un huésped intermedio. La ingestión de quistes maduros infecciosos (que poseen 4 núcleos), de comida, agua o manos contaminadas, va seguida de su excitación sólo cuando alcanzan la parte terminal del intestino delgado (íleo). El jugo gástrico no tiene efecto y no puede disolver la pared quística del quiste.
La exquistación es el proceso de transformación de los quistes en trofozoítos mediante la disrupción de la pared del quiste, a través de la acción de la enzima tripsina, lo que permite que emerja la ameba cuadri-nucleada e inicie la proliferación. La ameba sufre una ronda serie de divisiones nucleares seguidas de 3 rondas sucesivas de citocinesis (división celular) para producir 8 pequeños trofozoitos uninucleados, llamados amebulas. Bajo condiciones hostiles, también podrían producir quistes; una vez que se agregan a la capa de mucina del intestino acumulan una cantidad considerable de alimentos en forma de glucógeno, gránulos de cromátides en forma de barras negras y forman una pared de quiste delgada, redondeada y resistente. Por lo tanto, la enquistación ocurre en la luz del intestino, y la formación del quiste se completa cuando cuatro núcleos están presentes. Las señales que conducen a enquistación o exquistación son poco conocidas, pero podría ser desencadenada por la ligadura de una lectina de unión a una galactosa en la superficie del parásito. Después de eso, ambas etapas pasan en las heces: los trofozoítos generalmente están presentes en las heces blandas, mientras que los quistes se encuentran en las heces firmes. Debido a la protección conferida por sus paredes, los quistes pueden resistir las condiciones ambientales durante días o semanas y pueden ser responsables de la transmisión de la enfermedad. Sin embargo, una vez fuera del cuerpo, los trofozoítos que pasan en las heces se dañan rápidamente y, si se ingieren, no sobreviven a la exposición al entorno gástrico. Lo anterior describe la colonización típica asintomática que representa casi el 80 al 90% de todas las infecciones.
En 10 a 20% de las infecciones, cuando los trofozoítos colonizan el intestino al adherirse a la glucoproteína de la mucina colónica a través de galactosa y lectina específica de N-acetil D-galactosamina (Gal/ galNac), se alimentan de bacterias y desechos celulares y se someten a rondas repetidas de la división binaria. El daño al colon es causado por neutrófilos que responden a la invasión. Los trofozoítos también pueden invadir la barrera de la mucosa intestinal y obtener acceso al torrente sanguíneo, por lo que pueden diseminarse al hígado, al pulmón y a otros sitios con las manifestaciones patológicas resultantes. Desde estos sitios no pueden abandonar el huésped. Se muestra el ciclo en la siguiente imagen.
Biología celular
El tráfico vesicular es de suma importancia para el parásito, ya que la endocitosis y la fagocitosis sirven como mecanismos de absorción nutricional. La exocitosis de las cisteínas proteinasas y los poros de ameba implicados en la virulencia y los componentes de la pared del quiste, también son funciones importantes del tráfico vesicular, además de los roles más típicos en el transporte hacia y desde el retículo endoplásmico al complejo de Golgi y las superficies celulares. Esta complejidad de la función se refleja en la presencia de 91 genes Rab (en comparación con 11 en Saccharomyces cerevisiae) implicados en la fusión de vesículas. La glicosilación ligada a N de proteínas es inusual en que Man 5 GlcNAc 2 es el N- más abundante glucano unido, mientras que esto, en otras eucariotas, normalmente se procesa mediante la adición de azúcares ramificados.
Cinasas transmembrana
Las cinasas transmembrana de la E. histolytica (EhTMK) representan una de las principales clases de receptores de superficie celular y están implicadas en procesos celulares esenciales en casi todas las células eucariotas. Estas moléculas típicamente detectan señales ambientales y transducen las señales a rutas intracelulares apropiadas. La finalización de genomas secuenciados de protozoos humanos, infecciosos y no infecciosos, en los últimos años, ha permitido definir el kinoma de los parásitos.
Un EhTMK típicamente contiene cuatro dominios: péptido señal N-terminal, dominio extracelular rico en repeticiones CXXC, una única hélice transmembrana y un dominio similar a la tirosina-cinasa intracelular. Las EhTMKs se han subdividido en nueve subgrupos (A, B1-3, C, D1-2, E y F) en función de su dominio cinasa, así como la composición de la secuencia de los dominios extracelulares.
Las cinasas transmembrana están presentes y son extraordinariamente diversas (como en la imagen siguiente). Estas cinasas son más de 100 y forman parte de la familia de proteínas Gal /GalNAc relacionadas con lectinas que comparten los motivos extracelulares CXXC y CXC de la lectina intermedia (igl) subunidad. La actividad de la cinasa (serina/treonina vs. tyrosina) de las EhTMKs, sus sustratos, ligandos y funciones biológicas aún no se han determinado. Los efectores negativos inmediatos de las cinasas transmembrana aún no se han identificado, aunque se sabe que hay más de 100 proteínas fosfatasas presentes en el genoma. Una característica inusual de estas fosfatasas es la presencia de dominios de repetición ricos en leucina implicados en interacciones proteína-proteína. Existen numerosos receptores, siete acoplados a proteínas transmembrana y proteínas G triméricas. Se ha identificado bioquímicamente una adenilil-ciclasa regulada por proteínas G que funciona como retroalimentación negativa de un receptor de ligando adrenérgico. Las proteínas citosólicas implicadas en la transducción de señales incluyen Ras, rac, rab, rho y arf y sus factores de intercambio: proteínas de unión a calcio EFhand, fosfatidilinositol-3-OH cinasa, proteína cinasa C (PKC) y proteínas activadas por mitógenos (MAP) cinasas. Parece probable que este complejo sistema de señalización sea necesario para la adaptación del parásito a su huésped.
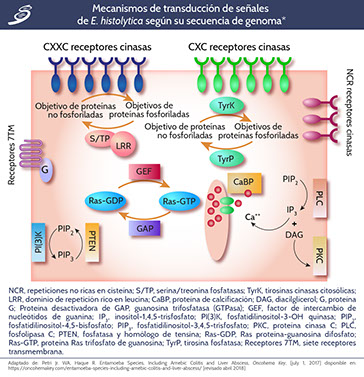
En la imagen previa se muestran los mecanismos de transducción de señales predichos de E. histolytica, basados en el análisis de los datos de la secuencia de su genoma. Posee tres tipos de receptores serina/treonina cinasas: un grupo tiene repeticiones CXXC en el dominio extracelular; un segundo tiene repeticiones CXC; y un tercio tiene repeticiones no ricas en cisteína (NCR). E. histolytica tiene tirosinas cinasas citosólicas (TyrK), pero no receptores tirosina cinasas. Algunas serina/treonina fosfatasas (S/TP) tienen un dominio de repetición rico en leucina (LRR).
E. histolytica después de la invasión intracelular
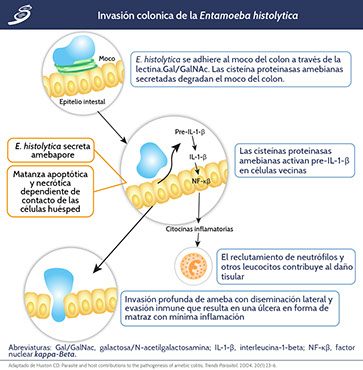
Las proteinasas amebianas degradan las mucinas y facilitan la penetración. El contacto con las células epiteliales conduce a la destrucción de células huésped por medio de apoptosis y necrosis, y a la activación de un marcador inflamatorio de las células epiteliales:
(I) Activación de factor nuclear kappa-beta (NF-kβ)
(II Secreción de pre-IL-1-β, IL-1- α, IL-8, IL-6, COX-2, GRO-α y GM-CSF
(III) Reclutamiento de leucocitos.
Abreviaturas: IL, interleucina; COX-2, ciclooxigenasa 2; GRO- α, oncogén relacionado con el crecimiento; GM-CSF, factor estimulante de colonias de granulocitos-macrófagos; IL-1-β, interleucina-1-beta; IL-1-α, interleucina 1- alfa.
La citotoxicidad amebiana y el daño tisular inducido por neutrófilos permiten una penetración profunda de la ameba y extensión lateral. Durante la infección crónica, las amebas evaden la respuesta inmune del huésped y la inflamación es mínima, a menudo, dada la destrucción del tejido. Sin embargo, las células T y macrófagos reclutados a la vista de la infección crónica pueden contribuir a la enfermedad por mecanismos autoinmunes.
Bibliografía
Petri Jr WA, Haque R. Entamoeba Species, Including Amebic Colitis and Liver Abscess, INFECTIOUS DISEASE, [Jul 1, 2017] disponible en: https://oncohemakey.com/entamoeba-species-including-amebic-colitis-and-liver-abscess/ [revisado febrero 2018]
Rayur. Amoebiasis: Definition, Causes, Symptoms, Diagnosis, Prevent And Treatment, Diseases [August 9th 2012] disponible en: http://www.rayur.com/amoebiasis-definition-causes-symptoms-diagnosis-prevent-and-treatment.html [revisado febrero 2018]
Dhawan VK. Amebiasis, Infectious Diseases, [Updated: May 22, 2017], disponible en:
https://emedicine.medscape.com/article/212029-overview#a3 [revisado marzo 2018]
Ayed LB y Sabbahi S. ENTAMOEBA HISTOLYTICA, GLOBAL WATER PATHOGEN PROJECT, 2017; 1-36
Abhyankar MM, Shrimal S, Gilchrist CA, Bhattacharya A, Petri WA Jr. The Entamoeba histolytica serum-inducible transmembrane kinase EhTMKB1-9 is involved in intestinal amebiasis, Int J Parasitol Drugs Drug Resist, 2012; 2:243-248.
Petri Jr. WA, Haque R. Entamoeba Species, Including Amebic Colitis and Liver Abscess, Oncohema Key, [july 1, 2017] disponible en: https://oncohemakey.com/entamoeba-species-including-amebic-colitis-and-liver-abscess/ [revisado abril 2018]
Huston CD. Parasite and host contributions to the pathogenesis of amebic colitis, Trends Parasitol, 2004; 20(1):23-6.
Aviso de privacidad
Diseño: A. Victoria Pérez
