EDUCACIÓN MÉDICA
Diarrea inflamatoriaEntamoeba HistolyticaCampylobacter jejuniClostridium DifficileSalmonellaShingellaVibrio ParahaemolyticusCitomegalovirus
ENFERMEDAD DIARRÉICA AGUDA BACTERIANA
FISIOPATOLOGÍA
Las tres principales causas etiológicas de diarrea bacteriana en el mundo son las especies de Salmonella (no tifoidea), Shigella y Campylobacter, seguidas de cerca por especies de Aeromonas.
Salmonella
La Salmonella es un grupo de bacterias descubiertas hace más de un siglo por el científico estadounidense Salomon, por quien adquirieron su nombre. Son una de las causas más comunes de infecciones infantiles como gastroenteritis, bacteremias y fiebre tifoidea (entérica). El género Salmonella pertenece a la familia de Enterobacteracia, se divide en dos especies: Salmonella enterica y Salmonella bongori (anteriormente clasificada como subespecie [subsp] V), clasificándose el primero en seis subespecies (I, S. enterica subsp. Enterica; II, S. enterica subsp. Salamae; IIIa, S. enterica subsp. Arizonae; IIIb, S. enterica subsp. Diarizonae; IV, S. enterica subsp. Houtenae; y VI, S. enterica subsp. indica). Mientras que una nomenclatura alternativa describe el género como una sola especie, Salmonella choleraesuis, la Comisión Judicial del Comité Internacional sobre la Sistemática de los Procariotas apoya la designación de dos especies.
Todas estas nomenclaturas y el hecho de estar divididas para su manejo clínico en: Salmonella tifoidea y No tifoidea (SNT) se presta a la confusión, se explicará a continuación sobre su clasificación microbiológica para su futuro entendimiento de patofisiología y manejo clínico.
La Salmonella es un bacilo anaerobio móvil, facultativo (raramente fermenta lactosa), gramnegativo; como en la siguiente Tabla, dentro de las siete subsp, se han observado más de 2 500 serotipos. Los niños menores de 5 años tienen mundialmente la tasa de incidencia más alta (69.5 infecciones por cada 100 000 niños). Salmonella Enteritidis fue el serotipo más común aislado (22% de los casos), seguido de Salmonella Newport (14%) y Salmonella Typhimurium (13%) (CDC, 1996-2010).

Las salmonelas se clasifican de acuerdo a la diversidad de su superficie antigénica: antígeno polisacárido O (somáticos), antígeno H (flagelares) y antígeno Vi (capsular). Las reacciones de aglutinación basadas en el antígeno-O son utilizadas por la mayoría de los laboratorios clínicos para dividir a la Salmonella en serogrupos que incluyen (pero no se limitan) a: A, B, C1, C2, D y E (Como se observan en la siguiente Tabla); estas cepas causan la mayoría de las infecciones por SNT en humanos. Para diferenciar los serotipos clínicamente significativos a medida que ocurre una reactividad cruzada, se requiere un proceso de serotipado formal generalmente hecho por laboratorios de referencia.

Por todo lo anterior, confirmamos que la nomenclatura y sintaxis de Salmonella es potencialmente confusa —¡pero no imposible!—, un ejemplo de una subespecie de Salmonella: la designación del serotipo es Salmonella enterica subespecie enterica serotipo Typhimurium, una abreviatura aceptada de esta designación taxonómica completa es Salmonella ser Typhimurium (en mayúscula y sin cursiva).
La Salmonella enterica subespecie enterica contiene casi todos los serotipos patogénicos para humanos. Aunque existen muchos serotipos de Salmonella, se pueden clasificar ampliamente como Salmonella tifoidea y no tifoidea (NTS) dependiendo del síndrome clínico con el que están predominantemente asociados (como en la Tabla previa). La salmonela tifoidea incluye la S. enterica subespecie enterica serotipos Typhi y Paratyphi A-C que típicamente causan enfermedad sistémica con poca o ninguna diarrea. El mayor grupo de SNT induce, principalmente, gastroenteritis aguda autolimitada. A continuación se revisará la fisiopatología de estas dos divisiones con fines clínicos para el entendimiento de la infección por Salmonella.
Salmonella No tifoidea
Se estima que las especies de SNT que se encuentran ampliamente en los animales causan más de 90 millones de enfermedades en todo el mundo y representan aproximadamente 155 000 muertes cada año.
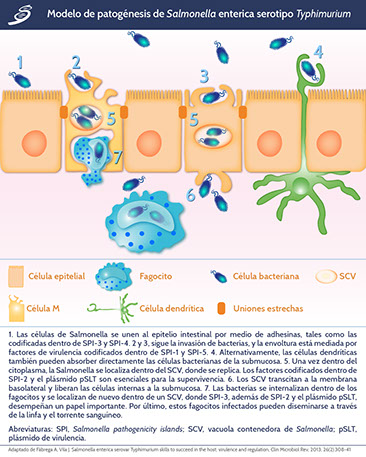
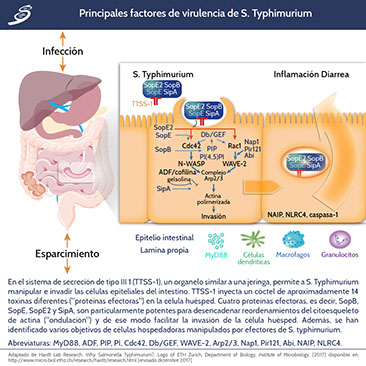
Para el caso de un individuo inmunocompetente, la infección por SNT induce una respuesta inflamatoria localizada, las fimbrias y los operones fimbriales de las bacterias facilitan la adherencia a la superficie celular, así como multiples genes, la adherencia es fundamental para la supervivencia e invasión. La Salmonella se adhiere a las células epiteliales, llamadas células M (microfold), que se superponen a los parches de Peyer en el colon. Las células M tienen actividad endocítica y transfieren el patógeno desde el lumen al área basal, lo que desencadena una respuesta inmune rápida. Después de invadir la célula, el patógeno está contenido dentro de un fagosoma modificado conocido como la vacuola que contiene Salmonella, en éste puede sobrevivir y replicarse, lo que contribuye a la capacidad de los microorganismos para diseminarse a la circulación y al sistema reticuloendotelial. El crecimiento bacteriano intracelular está limitado por mecanismos del sistema de inmunidad innata. La invasión también puede ocurrir a través de las células dendríticas que se extienden entre las células epiteliales o a través de los focos de los tejidos linfoides intestinales solitarios. La interacción del organismo con las células del huésped en el intestino por lo general desencadena la activación de citocinas proinflamatorias que atraen neutrófilos al sitio de infección y provocan los síntomas de la gastroenteritis. SNT induce la migración de neutrófilos al tracto gastrointestinal para facilitar su propia absorción; dicha migración de neutrófilos también causa el flujo paracelular de fluidos y electrolitos.
Existen factores predisponentes para una infección severa por SNT como disminución de acidez gástrica, deterioro en la inmunidad celular y humoral, y deterioro de la función fagocítica. En el caso de los neonatos, presentan una aclorhidria relativa (las salmonelas no pueden sobrevivir a un pH gástrico menor de 2.5) y alimentación con leche, factores que podrían favorecer una bacteremia por SNT.
La inmunidad de las células T es importante para controlar la Salmonella, como lo demuestra el aumento de la susceptibilidad a la SNT invasiva en la infección por VIH y con el uso de corticosteroides. La mayoría de las SNT no se extienden más allá de la lámina propia y linfática del intestino; las excepciones incluyen Salmonella choleraesuis y Salmonella dublin, que pueden causar bacteriemia con poca afectación intestinal.
En el caso de niños con defectos de la inmunidad humoral, incluida agammaglobulinemia ligada al cromosoma X y la inmunodeficiencia variable común, tienen un mayor riesgo de diarrea persistente y enfermedad invasiva. La función fagocítica alterada que se observa en la enfermedad granulomatosa crónica, las hemoglobinopatías y el paludismo también aumentan el riesgo de infección invasiva por STN. Además, se ha observado en algunos estudios que la coinfección con Schistosoma causa una enfermedad prolongada y grave debido a la función alterada de los macrófagos, con la replicación y supervivencia de la Salmonella cuidada dentro del parásito.
Salmonella tifoidea (fiebre entérica o tifoidea)
La Salmonella serotipo Typhi y Salmonella serotipo Paratyphi A, B y C (es decir, Salmonella tifoidea), son responsables de la fiebre tifoidea (entérica), infecciones infantiles (particularmente gastroenteritis) y bacteriemias. La Organización Mundial de la Salud (OMS) estima que existen de 16 a 33 millones de casos de fiebre tifoidea que causan entre 500 000 y 600 000 muertes en el mundo anualmente.
Los humanos son el único huésped y reservorio natural de Salmonella Typhi, sobrevive en cualquier tipo de agua durante días y en huevos contaminados y ostras congeladas durante meses. La cantidad de bacterias necesarias para causar infección oscila entre mil y un millón de organismos, la mayoría de las infecciones son por la ingestión de alimentos o agua contaminados con heces humanas. La fiebre paratifoidea requiere dosis infecciosas más altas de organismos ingeridos, y es más probable que se adquiera al consumir alimentos de vendedores ambulantes en comparación con los factores de riesgo domésticos.
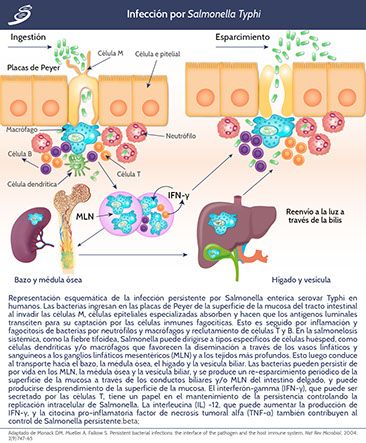
Salmonella Typhi no desencadena una respuesta inflamatoria temprana en el intestino; ésta elude la respuesta inflamatoria e invade y coloniza diferentes tejidos del cuerpo. Los organismos ingeridos se adhieren al epitelio intestinal del intestino delgado y penetran en la mucosa a través del tejido linfático de las placas de Peyer, posteriormente, los organismos se diseminan a través del sistema linfático o a través del torrente sanguíneo.
Salmonella Typhi usa dos mecanismos para ingresar a la submucosa: pueden atravesar las células M epiteliales especializadas, o penetrar directamente alrededor del tejido epitelial. El organismo interactúa con el regulador de conductancia transmembrana de la fibrosis quística (CFTR por sus siglas en inglés) que participa en la entrada de Salmonella Typhi en la célula epitelial.
Ya que se encuentra en las células epiteliales, Salmonella Typhi recluta monocitos y linfocitos, causando hipertrofia de las placas de Peyer. Esto, junto con la necrosis del tejido intestinal, podrían ser los mecanismos responsables de los cólicos abdominales y la perforación intestinal observados en la fiebre tifoidea. Las bacterias fagocitadas por monocitos o macrófagos alcanzan el hígado, bazo y médula ósea a través del torrente sanguíneo, replicándose así dentro del sistema reticuloendotelial, que clínicamente se traduce en malestar general severo, hepatoesplenomegalia y sepsis generalizada. Esta invasión intestinal y bacteriemia primaria ocurre dentro de las 24 horas posteriores a la ingestión de las bacterias. La diseminación ocurre principalmente durante la primera semana de la enfermedad y se caracteriza por episodios frecuentes de bacteriemia de alto grado.
A medida que la enfermedad clínica progresa, los organismos continúan siendo arrojados al torrente sanguíneo en niveles más bajos de bacteriemia. Además, la médula ósea es un sitio importante para la replicación, de ahí su importancia que se considera fuente de diagnóstico para el cultivo.
El estado de portador crónico se define como la excreción de bacterias en las heces u orina durante más de un año después de la infección aguda. El mecanismo para la persistencia de Salmonella parece estar asociado con un alelo particular presente en el gen Nramp1 y expresado en los macrófagos de modelos de ratones en investigación básica que se ha realizado.
Bibliografía
Haeusler GM, Curtis N. Non-typhoidal Salmonella in children: microbiology, epidemiology and treatment, Adv Exp Med Biol, 2013; 764:13-26.
Christenson JC. Salmonella Infections, Pediatrics in Review, 2013;34;375.
Bula-Rudas FJ, Rathore MH, Maraqa NF. Salmonella Infections in Childhood, Advances in Pediatrics, 2015; 62: 29–58
Chatterjee A. Pediatric Salmonella Infection, Pediatrics: General Medicine, [Updated: Jun 10, 2016] disponible en: https://emedicine.medscape.com/article/968672-overview#a5 [revisado diciembre 2017]
Chiu CH, Chuang CH, Chiu S, Su LH, Lin TY. Salmonella enterica serotype Choleraesuis infections in pediatric patients, Pediatrics, 2006; 117(6):e1193-6.
Centers for Disease Control and Prevention. Vital signs: incidence and trends of infection with pathogens transmitted commonly through food—foodborne diseases active surveillance network, 10 U.S. sites, 1996–2010. MMWR Morb Mortal Wkly Rep 2011;60(22):749–55.
Fàbrega A, Vila J. Salmonella enterica serovar Typhimurium skills to succeed in the host: virulence and regulation, Clin Microbiol Rev, 2013; 26(2):308-41
Hardt Lab Research. Why Salmonella Typhimurium?, Logo of ETH Zurich, Department of Biology, Institute of Microbiology, [2017] disponible en: http://www.micro.biol.ethz.ch/research/hardt/research.html [revisado diciembre 2017]
Monack DM, Mueller A, Falkow S. Persistent bacterial infections: the interface of the pathogen and the host immune system, Nat Rev Microbiol, 2004; 2(9):747-65.
Aviso de privacidad
Diseño: A. Victoria Pérez
