EDUCACIÓN MÉDICA
Infección por citomegalovirusMonucleosis infecciosaParotiditis viral aguda
INFECCIÓN POR CITOMEGALOVIRUS
FISIOPATOLOGÍA
El citomegalovirus (CMV) pudo cultivarse en un laboratorio por primera vez en 1956, donde se demostró que era la causa etiológica de la enfermedad de inclusión citomegálica en 1957.
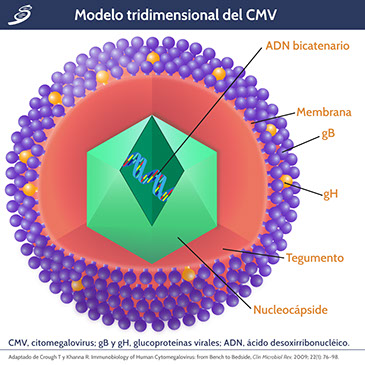
Citomegalovirus
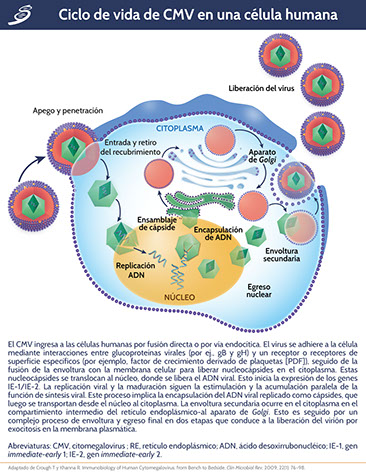
El CMV es miembro de una familia de 8 herpesvirus humanos, oficialmente está designado como herpesvirus humano tipo 5 (HHV-5). Taxonómicamente, el CMV se conoce como miembro de la subfamilia Beta Herpesviridae, en función a su propensión a infectar células mononucleares y linfocitos, y en su relación filogenética molecular con otros herpesvirus. Contiene un ácido desoxirribonucléico (ADN) bicatenario grande y lineal; su genoma se divide en una región única larga (UL) y una región única corta (uc), codifica una cantidad de 165-173 genes. La región UL contiene genes que producen diferentes proteínas, por ejemplo, UL54 (ADN polimerasa) y el producto del gen UL97 (fosfotransferasa). Además de la capa codificada de proteínas entre la envoltura del CMV y la cápside interna, el tegumento viral contiene proteínas que son objetivos principales de las respuestas inmunitarias mediadas por células hospedadoras, la más importante es la denominada proteína de tegumento principal, UL83 (fosfoproteína 65 [pp65]).
En orden de frecuencia, las patologías existentes, hasta ahora reportadas en las investigaciones de infección por CMV en pacientes inmunocompetentes, son las siguientes: tracto gastrointestinal (colitis), sistema nervioso central (meningitis, encefalitis, mielitis, parálisis nerviosas, mieloradiculopatía), manifestaciones hematológicas (anemia hemolítica y trombocitopenia), ojo (uveítis, retinitis), hígado (hepatitis), pulmón (neumonitis) y trombosis del sistema arterial y venoso (trombosis venosa profunda, trombosis de la vena porta, embolia pulmonar).
Infección congénita
El CMV se transmite verticalmente vía materna durante el embarazo, por vía perinatal o después de la exposición postnatal. Se ha descrito que esta transmisión ocurre de manera transplacentaria; durante la viremia de la infección materna, los leucocitos infectados pasan a la placenta, incluso, el CMV puede aislarse de la placenta después de una infección congénita; la placentitis se demuestra en el examen patológico placentario. La infección materna primaria durante el embarazo tiene una tasa de transmisión del 40% para el feto. De los fetos congénitamente infectados, 90% son asintomáticos al nacer, el 10% restante demuestra una amplia gama de manifestaciones en órganos y sistemas.
Mecanismo de infección congénita
Los mecanismos por los cuales el CMV daña al feto son una combinación de lesión celular fetal directa (particularmente en el sistema nervioso central fetal como se observa en la imagen) inducida por productos genéticos patológicos virales codificados, una respuesta inmune materna incompleta incapaz de controlar completamente la infección y el impacto de infección en la función placentaria, incluido el transporte de oxígeno y sustrato.
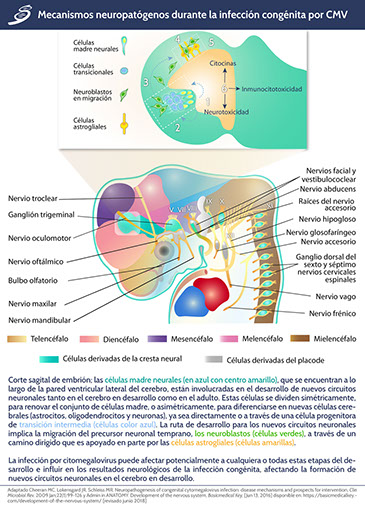
1. Infección de células madre neurales (azul con centro amarillo) que altera su capacidad para mantener un ciclo de autorrenovación, influyendo en procesos posteriores del desarrollo del cerebro.
2. Alteración de la diferenciación en células madre neurales a través de las células de transición (azul claro) y, finalmente, los neuroblastos.
3. Afección de los patrones migratorios de los neuroblastos (verde), particularmente durante el desarrollo cortical y cerebeloso, lo que puede implicar la inhibición de la migración a las estructuras cerebrales distales.
4. La afección del patrón migratorio puede causar una estratificación inadecuada de la neocorteza.
5. Se afectan las funciones de las células gliales en la dirección de los patrones de estratificación neuronal, secundario a la susceptibilidad importante a la infección por CMV.
6. Finalmente, la infección por CMV induce una gran cantidad de mediadores inflamatorios, como citocinas, radicales oxidativos y otros productos químicos neurotóxicos; éstos pueden afectar a la neurona inmadura al inducir directamente citotoxicidad o pueden afectar la función neuronal al alterar el microambiente que altera la fisiología normal de las células cerebrales.
Mecanismos de CMV como inhibidor de apoptosis
Las células del huésped infectadas tienen la apoptosis como un mecanismo de eliminación de células dañadas, también durante la organogénesis, es un mecanismo de defensa del feto para células infectadas por CMV. Por lo tanto, cualquier impacto de la infección por CMV en las vías apoptóticas celulares, podría jugar un papel potencial en los eventos teratogénicos.
La apoptosis es mediada por dos vías en la célula de los mamíferos: la intrínseca, que activa proteínas sensoriales como p53 e inicia una cascada de señales bioquímicas que conducen a la liberación mitocondrial del citocromo C, y la vía extrínseca, que se activa principalmente por señales externas involucrando al sistema inmune. La activación de la vía extrínseca conduce a la fosforilación de dichos receptores (dominios de muerte). Las intrínsecas y extrínsecas, convergen para inducir la activación de las proteasas de la caspasa, que lleva a la proteólisis de la arquitectura celular, trastorno metabólico, fragmentación genómica y, finalmente, muerte celular.
CMV ha desarrollado varios mecanismos para retrasar la vía de señalización apoptótica intrínseca. Las proteínas virales IE, IE1 (IE72) e IE2 (IE86), inhiben la apoptosis, esta inhibición mediada por CMV está asociada con secuestro de p53 por IE2. El CMV codifica otros dos genes que suprimen la apoptosis en la fase de replicación tardía. UL36 codifica un inhibidor de la activación de caspasa 8 (vICA) y UL37 (exón 1) codifica un inhibidor de la apoptosis localizado en mitocondrias virales (vMIA). La proteína vICA inhibe la apoptosis uniéndose a procaspasa 8, previniendo su modificación a una forma activa, mientras que vMIA inhibe la apoptosis interactuando con la molécula Bax (molécula pro-apoptótica) y secuestrándola dentro de la membrana mitocondrial en una forma inactiva, un proceso que requiere asociación de vMIA con balsas lipídicas internas en el retículo endoplásmico y membranas asociadas a mitocondrias. La replicación de CMV requiere la expresión de vMIA y la eliminación del gen UL37 en un virus recombinante, esto ocurre durante la infección intrauterina.
Papel de la inmunidad en la infección
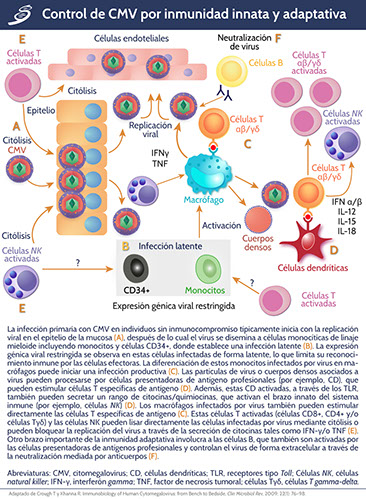
La respuesta inmune en la infección por CMV implica respuesta humoral y mediada por células. Su envoltura exterior derivada de la membrana nuclear de la célula huésped, contiene glucoproteínas codificadas por el virus; la glucoproteína B (gB) y la H (gH), las cuales son determinantes para la inmunidad humoral protectora en situación de inmunocompetencia, pero lo anterior es inadecuado para prevenir o evitar una infección transplacentaria.
Para el control de la infección, la principal respuesta necesaria del huésped es celular, por medio de células T citotóxicas, las cuales involucran un complejo mayor de histocompatibilidad de clase I (MHC I) restringida a la respuesta de linfocitos T CD8+. Aunque muchos productos de los genes virales generan estas respuestas, la mayoría de las células T, específicas a CMV, se dirigen a una fosfoproteína abundante en el tegumento viral pp65, producto del gen UL83.
Se ha cuantificado que los individuos expuestos a CMV dedican una mediana de 9.1% y 10.2% de sus células T CD4+ y CD8+ de memoria a este virus, reconociendo una mediana de 21 marcos abiertos diferentes de lectura de CMV por células T CD4+, CD8+ o ambas.
Cronicidad
La infección por CMV es usualmente asíntomática o levemente sintomática en bebés, niños y adultos, sin embargo, hay una gran morbilidad en los niños o adultos inmunocomprometidos, incluidos recién nacidos en este grupo. En neonatos o bebés infectados de forma congénita existe daño en el neurodesarrollo a largo plazo, por ejemplo, con pérdida auditiva neurosensorial.
La inhibición de los mecanismos apoptóticos, presumiblemente mantienen un lento ciclo de replicación que puede promover la propensión del CMV a establecer una infección crónica o latente.
Bibliografía
Schleiss MR. Pediatric Cytomegalovirus Infection, Pediatrics: General Medicine, [Updated: Jan 27, 2015] disponible en: https://emedicine.medscape.com/article/963090-overview#a5 [revisado: diciembre 2017]
Demmler-Harrison GJ. Acquired cytomegalovirus infection in children, UpToDate, [Literature review current through: Nov 2017/ Last updated: Sep 29, 2016] disponible en: http://www.uptodate.com/contents/acquired-cytomegalovirus-infection-in-children#subscribeMessage [revisado diciembre 2017]
Sever JL. Pediatric cytomegalovirus infections, Clinical and Applied Immunology Reviews 3, 2002; 47–59.
Plosa EJ, Esbenshade JC, Fuller MP y Weitkamp JH. Cytomegalovirus Infection, Pediatrics in Review, 2012;33;156
Wang D, Shenk T. Human cytomegalovirus virion protein complex required for epithelial and endothelial cell tropism, Proc Natl Acad Sci U S A, 2005; 102(50):18153-8.
Ryckman BJ, Jarvis MA, Drummond DD, Nelson JA, Johnson DC. Human cytomegalovirus entry into epithelial and endothelial cells depends on genes UL128 to UL150 and occurs by endocytosis and low-pH fusión, J Virol, 2006; 80(2):710-22.
Sylwester AW, Mitchell BL, Edgar JB, Taormina C, Pelte C, Ruchti F, et al. Broadly targeted human cytomegalovirus-specific CD4+ and CD8+ T cells dominate the memory compartments of exposed subjects, J Exp Med, 2005; 202(5):673-85.
Schleiss MR. Congenital cytomegalovirus infection: molecular mechanisms mediating viral pathogenesis, Infect Disord Drug Targets, 2011; 11(5):449-65.
Swanson EC, Schleiss MR. Congenital cytomegalovirus infection: new prospects for prevention and therapy, Pediatr Clin North Am, 2013; 60(2):335-49.
Cheeran MC, Lokensgard JR, Schleiss MR. Neuropathogenesis of congenital cytomegalovirus infection: disease mechanisms and prospects for intervention, Clin Microbiol Rev. 2009 Jan;22(1):99-126.
Admin in ANATOMY. Development of the nervous system, Basicmedical Key, [Jun 13, 2016] disponible en: https://basicmedicalkey.com/development-of-the-nervous-system/ [revisado junio 2018]
Crough T y Khanna R. Immunobiology of Human Cytomegalovirus: from Bench to Bedside, Clin Microbiol Rev, 2009; 22(1): 76–98.
Rafailidis PI, Mourtzoukou EG, Varbobitis IC, Falagas ME. Severe cytomegalovirus infection in apparently immunocompetent patients: a systematic review, Virol J, 2008; 5:47.
Aviso de privacidad
Diseño: A. Victoria Pérez
