EDUCACIÓN MÉDICA
CEFALEAS PRIMARIAS
FISIOPATOLOGÍA DE MIGRAÑA
Las características clínicas de la migraña incluyen: cefalea punzante (generalmente unilateral), náuseas, vómitos, fotofobia, fonofobia y a menudo trastornos neurológicos severos. Actualmente se diagnostica clínicamente basándose en la Clasificación Internacional de los Trastornos de Cefalea 3ª Edición (ICHD-III), que clasifica formalmente la migraña en dos subtipos principales: migraña sin aura (MO) y migraña con aura (MA). Éstos tienen una superposición sintomática sustancial; sin embargo, los pacientes con MA también experimentan fenómenos neurológicos distintivos que preceden a un ataque de cafela. Se le conoce como aura a la entidad multifacética de diversos síntomas neurológicos que anteceden a la cefalea, se han descrito como formas "centellantes" o manchas negras en el campo visual o alucinaciones propiamente.
La ICHD-III también describe otros subtipos de migraña: la migraña crónica que se diagnostica en pacientes que experimentan síntomas frecuentes o casi continuos de migraña, relacionándose con el uso excesivo de medicamentos; más del 50% de las mujeres que padecen MO mencionan que existe una asociación de la sintomatología con su periodo menstrual, lo que ha llevado a la clasificación posterior de la migraña menstrual. Además de las clasificaciones previas, existe la migraña hemipléjica (HM) que es una forma rara y grave de MA que también presenta síntomas de debilidad motora.
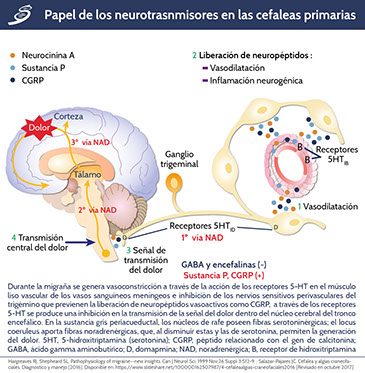
La fisiopatología de la migraña sólo se entiende parcialmente, pero se cree que es causada por la activación del sistema trigeminovascular. La fase de cefalea de un ataque de migraña se cree que es el resultado de la activación de los nociceptores que inervan los vasos sanguíneos craneales, que transmiten una señal a las neuronas bipolares del trigémino; esto se retransmite más adelante a las áreas talámicas y corticales, produciendo la sensación del dolor. La señal de las neuronas perivasculares es transmitida por los neuropéptidos vasoactivos relacionados con el gen de la calcitonina (CGRP), sustancia P (SP) y óxido nítrico, dando como resultado una cascada de eventos que conducen a la liberación de mediadores inflamatorios vasoactivos, inflamación en las meninges y la sensibilización del dolor en las regiones pertinentes del tronco encefálico. La activación trigeminal es un evento descendente, considerándose así que la propagación de despolarización cortica (CSD, por sus siglas en inglés) puede ser productora, por una parte, de los síntomas de la migraña, valorándose como una probable ruta desencadenante del dolor. La CSD es una onda de propagación lenta de la despolarización neuronal y glial, acompañada de flujos iónicos masivos que se extiende a través de la corteza cerebral y que es seguida por una supresión duradera de la actividad neuronal, pensándose que esta también se encuentra inmiscuida en el proceso del aura de migraña. En la siguiente imagen se puede observar el papel de los neurotrasnmisores en las cefaleas primarias.
El inicio de la CSD se ha demostrado experimentalmente después de estímulos nocivos que conducen a una acumulación de glutamato en el ambiente neuronal, que entonces activa patológicamente los canales de calcio y sodio, particularmente los receptores de N-metil-D-aspartato (NMDA). También desempeñan un papel fundamental en los mecanismos de inicio de la cefalea, asociándose con la apertura de canales de Pannexin 1 causando la activación de caspasa-1 y la liberación de anfoterina (también conocida como proteína de alta movilidad del grupo B1 [HMGB1, por sus siglas en inglés]), que inicia las vías inflamatorias parenquimatosas y puede proporcionar el estímulo para la activación trigeminal de manera sostenida. Además, la mayoría de los pacientes con migraña no experimentan aura, por lo que también pueden ser importantes los desencadenantes alternativos de la activación trigeminovascular como: hiperexcitabilidad cortical, trastornos cerebrales o las disfunciones hipotalámicas. Los estudios clínicos y neurofisiológicos confirman que los individuos que padecen migraña presentan hipersensibilidad crónica a los estímulos sensoriales y/o procesamiento anormal de la información sensorial.
CEFALEA TIPO TENSIONAL Y CEFALALGIAS AUTÓNOMAS TRIGEMINALES
La sensibilidad pericraneal es el hallazgo extracefálico más documentado y reproducible en pacientes con cefalea de tipo tensional (CTT). El papel de los neurorreceptores es muy importante en la CTT; los receptores de NMDA han sido implicados en un papel central de la patogénesis del dolor, producida en el área dorsal y el núcleo del trigémino. El receptor NMDA, junto con otros receptores de soporte tales como propionato de α-amino-3-hidroxil-5-metil-4-isoxazol (AMPA), se encuentran en la membrana postsináptica de las neuronas de segundo orden. La excitación glutaminérgica de los receptores de NMDA conduce a la activación de la proteína cinasa C, que a su vez facilita la producción de moléculas implicadas en el dolor tales como ciclooxigenasa-2 (COX-2), óxido nítrico (ON) y proteína Fos.
Alam y colaboradores, encontraron niveles normales de glutamato en el plasma de pacientes con CTT. Sin embargo, esto no excluye la participación del glutamato, ya que muchas de las adaptaciones en la sensibilización central implican cambios que se producen en los receptores NMDA y AMPA en la membrana postsináptica. Se cree que las β-endorfinas están implicadas en las vías descendentes antinociceptivas, mientras que los niveles de estas están positivamente correlacionados con umbrales de dolor significativamente más bajos en pacientes con CTT.
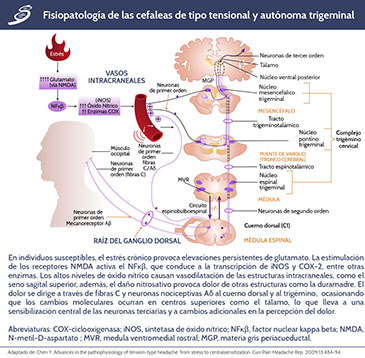
El ON está íntimamente implicado en el procesamiento del dolor en el sistema nervioso central y más notablemente en la migraña. El ON media muchos de los efectos de la activación del receptor NMDA en neuronas de segundo orden. La óxido nítrico sintasa (NOS) tiene tres formas: NOS endotelial, NOS neuronal y una forma inducible (iNOS) también encontrada en células de la glia y otras células neuronales. De manera simplificada, cuando NOS es activada, se forma ON, se difunde a través de membranas celulares locales y activa la guanosina monofosfato cíclico, lo que conduce a una disminución de calcio celular. Esto, a su vez, conduce a la vasodilatación vascular a través de su acción en las células endoteliales, en las arterias y las venas, mientras que en otros tejidos ON se acopla con superóxido y actúa como una molécula nociva que desencadena las vías del dolor. Muchas neuronas y células gliales poseen esta capacidad; por lo tanto, los estudios en seres humanos se han concentrado en simular la liberación de NOS in vivo con un portador del grupo NO-trinitrato de glicerilo (GTN), éste es un portador de ON soluble en lípidos que puede atravesar la barrera hematoencefálica y traer ON a los tejidos locales. Parte de la fisiopatología que se encuentra en las cefaleas de tipo tensional y autónoma trigeminal, la podemos observar en el siguiente esquema.
La distribución del dolor en este tipo de cefaleas implica en gran medida la actividad de los nervios trigémino y cervical superior. El sistema trigeminovascular es el centro de la fisiopatología de las cefaleas neurovasculares; la activación del nervio trigémino puede explicar el dolor y puede iniciar algunas de las manifestaciones autonómicas.
CEFALEA EN RACIMOS
Este tipo de cefaleas pertenecen a las trigemino-autonómicas y es considerado como uno de los tipos de cefalea más doloroso, cuya presentación se caracteriza por dolor intenso y activación autónoma importante que pueden incluir lagrimeo, rinorrea y miosis. Una característica única de la cefalea en racimos en la forma episódica es la periodicidad circadiana y circanual. La cefalea en racimos episódica comúnmente ocurre al menos una vez al día durante un período de semanas, a la misma hora del día o de la noche. Los períodos activos (6-12 semanas) son seguidos por una remisión temporal que puede durar de semanas a años (12 meses). Los ataques tienden a ser más cortos y menos severos al principio y hacia el final de cada período de cefalea. Se ha reportado que los períodos activos de cefalea en racimos son estacionales y se pueden producir alrededor de la primavera u otoño, e incluso se ha observado una correlación entre los cambios en las horas diurnas o la reubicación geográfica y la aparición y frecuencia de la cefalea en racimos.
Hay dos presentaciones temporales distintas de la cefalea en racimos; la mayoría (80-85%) sufren del tipo episódico caracterizado por al menos dos períodos de dolor separados por períodos sin dolor que pueden ser igual o mayor a un mes. En la cefalea en racimos crónica, los ataques repetidos se presentan durante más de un año sin remisión o, con remisión, cuyo período duran menos de un mes, sin embargo, en el transcurso de la enfermedad, la duración de los ataques tiende a alargarse tanto en la cefalea en brotes episódica como crónica.
Sorprendentemente para un síndrome tan dramático, el intervalo de tiempo para un diagnóstico final fue de 3-6 años, además que un 34 a 45% de los pacientes han llegado a consultar a un dentista y 27-33% a un otorrinolaringólogo antes de un diagnóstico preciso. Entre los factores que aumentan el retraso en el diagnóstico se encuentran los patrones de referencia, la presencia de características migrañosas, un patrón de ataque episódico y una edad temprana de inicio.
Bibliografía
1. Zarcone D, Corbetta S. Shared mechanisms of epilepsy, migraine and affective disorders. Neurol Sci. 2017;38:73-76.
2. Pisanu C, Preisig M, Castelao E, et al. A genetic risk score is differentially associated with migrainewith and without aura. Hum Genet. 2017; 136:999-1008.
3. Hartl E, Angel J, Rémi J, et al. Visual Auras in Epilepsy and Migraine - An Analysis of ClinicalCharacteristics. Headache. 2017;57:908-916.
4. Lantz M, Sieurin J, Sjölander A, et al. Migraine and risk of stroke: a national population-based twinstudy. Brain. 2017;1;140:2653-2662.
5. Chen Y. Advances in the pathophysiology of tension-type headache: from stress to centralsensitization. Curr Pain Headache Rep. 2009;13:484-94.
6. Comité de Clasificación de la Cefalea de la Internacional Headache Society (IHS). III Edición de la Clasificación Internacional de las Cefaleas. Versión beta [Marzo 2013]. Consultado en: http://www.sen.es/pdf/2014/cic3_beta.pdf. [Revisado en 2017]
7. Hargreaves RJ, Shepheard SL. Pathophysiology of migraine--new insights. Can J Neurol Sci. 1999 Nov;26 Suppl 3:S12-9.
8. Benoliel R. Trigeminal autonomic cephalgias. Br J Pain. 2012 AUG; 6(3): 106-123.
Aviso de privacidad
Diseño: A. Victoria Pérez
